Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
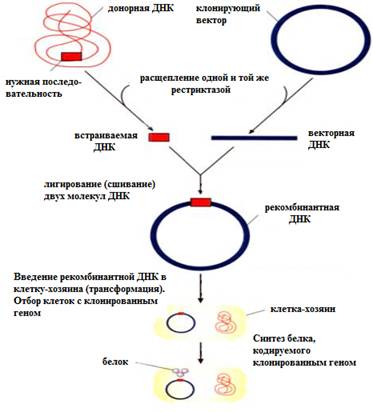
Молекулярно-генетические методыМолекулярно-генетическиеметоды изучения наследственности человека – это большая группа методов, позволяющих выявлять варианты структуры исследуемого участка ДНК. В основе методов лежат различные манипуляции с ДНК и РНК. Выделение ДНК Первым этапом любого молекулярно-генетического исследования является выделение нуклеиновых кислот из образца ткани. Для выделения ДНК пригодны любые ядросодержащие клетки организма. Чаще всего на практике используется периферическая кровь (лейкоциты). Выделенная из клеток ДНК представляет собой весь геном организма (геномная ДНК). Для выделения ДНК применяется обработка крови солевыми растворами различной концентрации для разрушения плазматической мембраны и ядерной оболочки и очистка препаратов. Выделенная ДНК пригодна для любых молекулярно-генетических исследований и может продолжительное время сохраняться в замороженном виде. В большинстве случаев для анализа (например, для диагностики болезни) достаточно исследования небольшого фрагмента генома. Для этого исследуемый фрагмент необходимо получить в большом количестве копий (амплифицикация). Амплифицировать фрагмент ДНК можно при помощи методов молекулярного клонирования и полимеразной цепной реакции (ПЦР). Молекулярное клонирование Молекулярное клонирование (генная инженерия, технология рекомбинантных ДНК) – это совокупность методов, позволяющих осуществлять перенос генетического материала (ДНК) из одного организма в другой. Молекулярное клонирование состоит из следующих этапов: · Выделение ДНК из организма – донора;  · Расщепление ДНК ферментами рестриктазами с образованием фрагментов ДНК с «липкими концами»; · Расщепление векторной молекулы (плазмида, фаг, космида и др.) той же рестриктазой, что и исследуемый образец ДНК; · Лигирование (сшивание) векторной молекулы и фрагмента исследуемой ДНК с образованием гибридной (рекомбинантной) молекулы; · Введение рекомбинантной молекулы в клетку-хозяина (реципиента). Этот процесс называется трансформацией. · Отбор клеток, несущих рекомбинантную ДНК (трансформированные клетки); · Получение специфического белкового продукта, синтезируемого клетками-хозяевами. Для молекулярного клонирования необходимо: 1. Ферменты рестриктазы 2. Клонирующий вектор 3. Встраиваемая ДНК (ген, фрагмент гена)
Рестриктазы – ферменты, разрезающие ДНК в строго определенном месте (сайте). Рестриктазы выделяют из клеток бактерий разных видов. Каждая рестриктаза узнает только свой сайт рестрикции. В настоящее время выделено более 500 рестриктаз. Например, рестриктаза EcoRI узнает и расщепляет ДНК по палиндромной нуклеотидной последовательности GAATTC. В результате расщепления образуются комплементарные одноцепочечные «липкие» концы: GAATTC CTTAAG → обработка рестриктазой EcoRI →
G AATTC CTTAAG G
Векторами для молекулярного клонированияявляются молекулы ДНК, которые могут доставлять в клетку-хозяина чужеродную ДНК. Вектор должен быть небольшого размера, иметь сайт рестрикции, в который может быть осуществлена вставка, иметь один или более селективный генетический маркер для отбора реципиентных клеток, несущих чужеродную ДНК. Векторами для клонирования являются: 1. Плазмиды – кольцевые двухцепочечные экстрахромосомные самореплицирующиеся молекулы ДНК бактерий. В плазмидах клонируют фрагменты ДНК до 10 т.п.н. 2. Фаги. Первыми были разработаны выкторы на основе фага λ E. coli. ДНК фага λ составляет примерно 50 т.п.н. Значительная часть (20т.п.н.) несущественна для размножения фага и может быть заменена на чужеродную ДНК. В фаге можно клонировать фрагмент ДНК до 20т.п.н. 3. Космиды – векторы, объединяющие в себе свойства плазмиды и фага. Созданы искусственно. Могут амплифицироваться в бактерии как плазмиды и упаковываться в фаговые головки. Могут включать вставку чужеродной ДНК до 40т.п.н. 4. Искусственная дрожжевая хромосома (yeast artificial chromosome –YAC). Вектор разработан на основе ДНК дрожжей. Применяются для клонирования больших фрагментов ДНК (от 100 до 1000 т.п.н.) эукариот. Схема молекулярного клонирования
С использованием технологий рекомбинантных ДНК получают инсулин, соматотропный и другие гормоны человека.
Полимеразная цепная реакция (ПЦР) Метод амплификации (увеличение количества копий) ДНК in vitro. Метод позволяет в течение нескольких часов получить большое количество копий исследуемой ДНК. Возможность осуществления репликации ДНК в пробирке давно интересовала ученых. Особенно интересной представлялась возможность накопления большого количества копий ДНК для последующих исследований. Этот процесс стал возможным после открытия термостабильной Tag-полимеразы из термофильных бактерий Thermis aquaticus. Принцип метода ПЦР был разработан Кэри Мюллисом (США) в 1983 году и в настоящее время используется как для научных целей, так и для диагностики в практическом здравоохранении. В основе метода ПЦР лежит комплементарное достраивание ДНК-матрицы, осуществляемое in vitro с помощью фермента ДНК-полимеразы (т.е. осуществляется репликация). Обычная ДНК-полимераза не может работать при высоких температурах. Оптимум работы Tag-полимеразы находится в области 70-72 С, что позволило сделать процесс репликации циклическим. При многократном повторении циклов синтеза происходит экспоненциальное увеличение числа копий специфического фрагмента ДНК, что позволяет из небольшого количества анализируемого материала (не определяемое современными методами) получить достаточное количество копий ДНК для идентификации их методом электрофореза. Комплементарное достраивание цепи начинается не в любой точке последовательности ДНК, а только в определенных стартовых блоках – коротких двунитевых участках. При присоединении таких блоков к специфическим участкам ДНК можно направлять процесс синтеза новой цепи только в этом участке, а не по всей длине цепи. Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные затравки – праймеры. Праймеры комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК протекает только между ними. Таким образом, метод ПЦР представляет собой многократное увеличение числа копий (амплификация) специфического участка ДНК, катализируемое ферментом ДНК-полимеразой. Каждый цикл амплификации включает 3 этапа, протекающих в различных температурных режимах. 1 этап: Денатурация ДНК. Протекает при 93-94 С в течение 30-40 сек. 2 этап: Присоединение праймеров (отжиг). Присоединение праймеров происходит комплементарно к соответствующим последовательностям на противоположных цепях ДНК на границах соответствующего участка. Для каждой пары праймеров существует своя температура отжига, значения которой располагаются в интервале 50-65 градусов. Время отжига 20-60 сек. 3 эпап: Достраивание цепи (элонгация). Комплементарное достраивание цепей происходит от 5’-конца к 3’-концу в противоположных напрвлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей служат добавляемые в раствор нуклеотиды. Синтез происходит при температуре 70-72 С, время синтеза – 20-40 сек. Образовавшиеся в первом цикле амплификации новые цепи ДНК служат матрицами для нового цикла амплификации, в котором происходит образование искомого специфического фрагмента ДНК (ампликона). В последующих циклах амплификации ампликоны служат матрицей для синтеза новых цепей. Таким образом, происходит накопление ампликонов в растворе по формуле 2n, где n- число циклов амплфикации. Поэтому, даже если в исходном растворе первоначально находилась всего одна двухцепочечная молекула ДНК, то за 30-40 циклов в растворе накапливается около 10 в восьмой степени молекул ампликона. Этого количества достаточно для достоверной визуальной детекции этого фрагмента методом электрофореза в агарозном геле. Процесс амплификации проводится в специальном программируемом термостате (амплификаторе), который по заданной программе осуществляет смену температур согласно числу циклов амплификации. Применение ПЦР: Клиническая лабораторная диагностика • диагностика вирусных инфекций (ВИЧ, гепатит, половые инфекции и др.) • определение отцовства • диагностика генных болезней (выявление мутаций) • судебная медицина (напр. Идентификация личности) Фундаментальная наука и практика • секвенирование (определение нуклеотидной последовательности ) • клонирование генов • генная инженерия (создание трансгенных животных и растений) • генная терапия • направленный мутагенез
Схема ПЦР
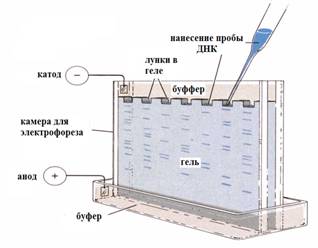
Электрофорез фрагментов ДНК Электрофорез применяется для визуализации результатов экспериментов (ПЦР и др.). Электрофорез фрагментов ДНК обеспечивает их разделение и распределение в агарозном или полиакриламидном геле. Фрагменты ДНК движутся в электрическом поле от отрицательного полюса к положительному в зависимости от их размеров. Чем больше молекулярная масса фрагмента, тем медленнее он движется в электрическом поле. После окончания электрофореза каждый фрагмент ДНК занимает определенное положение в геле в виде полосы. Длину каждого фрагмента можно определить путем сравнения пройденного фрагментом расстояния с расстоянием, пройденным стандартным образцом ДНК с известным размером (маркер). Для визуализации результатов экспериментов гели окрашивают. Чаще всего применяется окраска геля этидия бромидом, который связывается с ДНК. Полосы, соответствующие фрагментам ДНК выявляются при ультрафиолетовом облучении геля (свечение в красной области спектра).
При использовании ПЦР с последующим разделением фрагментов при помощи электрофореза можно обнаружить делеции и вставки в исследуемом гене. В случае делеций после ПЦР образуются фрагменты меньшей длины по сравнению с нормальным геном, а в случае вставок (дупликаций) - большей. Замены оснований не изменяют длину фрагментов, поэтому для их определения можно использовать метод полиморфизма длины рестрикционных фрагментов и секвенирование. Метод полиморфизма длины рестрикционных фрагментов Значительное число нуклеотидных замен приводит к появлению в последовательности ДНК новых сайтов для различных рестриктаз. В результате нормальный фрагмент ДНК и фрагмент с заменой нуклеотида будут разрезаться одной рестриктазой на разное число фрагментов, отличающихся по длине. Различной длины фрагменты легко выявляются при помощи электрофореза. Примером может служить рестрикционный анализ фрагмента гена алькогольдегидрогеназы (ADH). После ПЦР образуется фрагмент 165 н.п. Аллель ADH-1 не несет замены, после его обработки рестриктазой MaeIII при электрофорезе выявляются 2 фрагмента (98 и 68 н.п.). Аллель ADH-2 несет нуклеотидную замену (при замене образуется лишний сайт для рестриктазы) и после рестрикции разрезается на 3 фрагмента (63, 36 и 68 н.п.).
Секвенирование ДНК Секвенирование – определение нуклеотидной последовательности ДНК. Метод применяется для изучения генома человека как в норме так и в патологии. При помощи секвенирования определяют аллельные варианты генов, а также различные типы генных мутаций (чаще по замене оснований). Программа «Геном человека», результатом которой явилась расшифровка нуклеотидной последовательности генома человека (основная часть программы закончена в 2003г.) была осуществлена с применением методов секвенирования ДНК. Существует несколько различных способов секвенирования ДНК. Первым был предложен химический метод Максама-Гилберта, затем ферментативный метод Сенгера. В настоящее время в основном применяется дидезоксинуклеотидный метод секвенирования ДНК (метод обрыва цепи). В этой процедуре одноцепочечная молекула ДНК, последовательность которой определяется, служит матрицей для синтеза серии комплементарных цепей, обрывающихся в момент присоединения к растущей цепи специфических нуклеотидов. Для обрыва синтеза используют дидезоксинуклеотиды – искусственно синтезированные нуклеотиды, лишенные 2' и 3'- гидроксильных групп и поэтому не способные присоединять к цепи следующий нуклеотид. Проба ДНК делится на 4 пробирки, в которые добавляют праймер, ДНК-полимеразу, смесь четырех трифосфатов (дАТФ, дГТФ, дТТФ, дЦТФ) и небольшое количество одного из дидезокирибонуклеотидов (ддАТФ, ддГТФ, ддТТФ, ддЦТФ). Во время синтеза ДНК-полимераза случайным образом включает в цепь нормальные нуклеотиды и дидезоксинуклеотиды. При этом в каждой пробирке образуется набор фрагментов разной длины, заканчивающихся на один из дидезоксинуклеотидов. После этого проводится электрофорез, что позволяет разделить отличающиеся на один нуклеотид фрагменты ДНК. В результате в геле образуется набор полос, напоминающих лестницу. Нуклеотидная последовательность ДНК читается в геле снизу вверх, согласно направлению 5'-3' цепи ДНК. Для определения нуклеотидной последовательности больших фрагментов ДНК используются автоматизированные машины (ДНК-секвенаторы).
Кроме перечисленных, применяется большое количество других молекулярных методов изучения последовательности человека.
Биохимические методы Широко применяются в лабораторной диагностике наследственных болезней. Биохимические методы направлены на выявление биохимического фенотипа организма. Биохимическими методами можно обнаружить накопленные патологические метаболиты в крови, моче, поте и др. Например, широко используется количественный тест с хлоридом железа для определения фенилкетонурии. В настоящее время разработано много тестов для выявления генных мутаций. Таким образом, биохимические и молекулярно-генетические методы применяются для диагностики генных болезней.
Генные болезни Генные болезни – большая группа клинически разнородных заболеваний, причиной которых являются мутации на генном уровне. Закономерности наследования генных болезней соответствуют менделеевским правилам расщепления в потомстве (менделирующие признаки). Наследование некоторых патологических генов может несколько отличаться от менделеевских закономерностей в связи с наличием таких эффектов как летальность и стерильность. У человека к развитию генных болезней могут приводить все известные типы генных мутаций: замены оснований, сдвиг рамки считывания, нарушения сплайсинга, увеличение числа тринуклеотидных повторов. Одна и та же генная болезнь может быть обусловлена разными мутациями. Например, в гене муковисцидоза описано около 200 вызывающих болезнь мутаций. Генные мутации могут приводить к отсутствию синтеза белка, к избыточному синтезу белка, количественно недостаточному синтезу или синтезу аномального белка. Классификация генных мутаций. В основу классификации генных болезней могут быть положены три принципа: генетический, клинический и патогенетический. Клинический принцип классификации основан на отнесении болезни к той или иной группе в зависимости от системы и органа, наиболее вовлеченного в патологический процесс. Различают генные болезни нервной системы, глазные, кожные, болезни опорно-двигательной системы, желудочно-кишечного тракта и др. Патогенетическая классификация выявляет основное звено звено патогененза. Выделяют болезни с нарушением обмена веществ (болезни углеводного и аминокислотного обмена, обмена витаминов, липидов и др.), с развитием аномалий морфогенеза или комбинации того и другого. Генетическая классификация подразделяет генные болезни на группы согласно типам наследования: аутосомно-доминантные, аутосомно-рецессивные, Х-сцепленные доминантные, Х-сцепленные рецессивные, У-сцепленные и митохондриальные. В данном пособии генные болезни классифицированы согласно с генетическим принципом классификации. К клиническим особенностям генных болезней относятся многообразие проявлений, варьирующий возраст начала болезни, хроническое течение. В большинстве случаев генные болезни характеризуются тяжелым течением, что приводит к инвалидности и сокращению продолжительности жизни.
Генные болезни
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 302. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |