
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
МОДУЛЬ 1. ТЕМА: Качественный анализ. Аналитические реакции анионов
Аналитические реакции анионов первой аналитической группы: SO42-, SO32-, S2O32-, С2О42-, СО32-, В4О72- (BO2- ), Р043-, AsO43-, AsO33-, F-
Групповым реагентом на анионы первой аналитической группы является, как было указано выше, водный раствор хлорида бария ВаС12, с которым анионы данной группы образуют осадки соответствующих бариевых солей, малорастворимые в нейтральных или слабо щелочных водных растворах. Поэтому реакции с групповым реагентом и проводят в нейтральной или слабо щелочной среде. Осадки бариевых солей рассматриваемых анионов растворяются в минеральных кислотах, за исключением сульфата бария BaS04. Карбонат ВаСО3, тетраборат ВаВ407, ортофосфат, Ва3(Р04)2 и арсенат Ba3(As04)2 растворимы и в уксусной кислоте. Катионы серебра Ag+ также дают осадки солей серебра с анионами первой группы, за исключением фторид-аниона F-, поскольку фторид серебра AgF растворим в воде. Эти осадки растворяются в азотнокислом растворе, в отличие от солей серебра анионов второй аналитической группы. Соли свинца анионов первой группы также нерастворимы в воде, за исключением тетрабората и периодата. Анионы первой аналитической группы в водных растворах бесцветны. Первая группа включает как анионы-окислители (As04, иногда также СrO42-, Сг2O72-), так и восстановители (AsO33-,S2O32-, SO32-, С2О42-). Под действием минеральных кислот анионы «летучих» кислот (СО32-, SO32- и S2O32-) разрушаются с выделением газообразных С02 или S02. Аналитические реакции сульфат-иона S042-. Сульфат-ион —анион сильной двухосновной серной кислоты H2S04 (рК2 = 1,94). В водных растворах бесцветен, практически не гидролизуется, обладает окислительными свойствами, которые, однако, в разбавленных растворах обычно не реализуются. Сульфат-ион как лиганд образует сравнительно малостойкие сульфатные комплексы металлов.  Сульфаты аммония и многих металлов хорошо растворяются в воде. Сульфата кальция, стронция, бария, свинца(II) малорастворимы в воде, что широко используется в химическом анализе. Реакция с катионами бария (фармакопейная). Сульфат-ионы при взаимодействии с катионами бария Ва2+ образуют белый мелкокристаллический осадок сульфата бария BaS04: Ba2++S02- ->BaS04 Осадок не растворяется в минеральных кислотах, за исключением концентрированной H2S04, в которой он частично растворим с образованием Ba(HS04)2: BaS04 +H2S04 -> Ba(HS04)2 Если в растворе присутствует перманганат калия КМп04, то осадок сульфата бария окрашивается в фиолетово-красный цвет за счет адсорбции перманганат-ионов Мп04- на осадке. Методика. В пробирку вносят 3—4 капли раствора сульфата натрия Na2S04 (или другого растворимого сульфата), прибавляют каплю разбавленного раствора НС1 и 2—3 капли раствора ВаС12. Выпадает белый осадок сульфата бария. Реакция с катионами свинца. Сульфат-ион дает с катионами свинца РЬ2+ белый кристаллический осадок сульфата свинца PbS04: Pb2++S042- =PbS04 Осадок частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4, с образованием комплексных соединений. Растворение в щелочах: PbS04 + 4NaOH = Na2[Pb(OH)4] + Na2S04 Комплексам, образующимся при растворении сульфата свинца в растворах ацетатов натрия и аммония, различные исследователи приписывают неодинаковый состав. Методика. В пробирку вносят 3—4 капли раствора сульфата натрия и прибавляют 2—3 капли раствора нитрата свинца Pb(N03)2. Выпадает белый осадок сульфата свинца.
Реакция с родизонатом бария. Сульфат-ионы при взаимодействии с красным родизонатом бария разрушают его с образованием сульфата бария, вследствие чего красный родизонат бария обесцвечивается:
родизонат бария родизонат-анион — остаток родизоновой кислоты H2C6H6 Реакция высокочувствительна: предел обнаружения 5 мкг. Реакцию обычно проводят капельным методом на фильтровальной бумаге. Методика. На листок фильтровальной бумаги наносят каплю раствора хлорида бария ВаС12 и 1 каплю раствора родизоната натрия Na2C606 или родизоновой кислоты Н2С606. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1—2 капли раствора, содержащего сульфат-ионы (разбавленной серной кислота или растворимых сульфатов). Пятно обесцвечивается. Аналитические реакции сульфит-иона SO32-. Сульфит-ион SO32- и гидросульфит-ион HSO3- — анионы двухосновной нестабильной в водных растворах сернистой кислоты H2S03, которая при ионизации по первой стадии является кислотой средней силы (рК1 = 1,85), а по второй — очень слабой (рК2 = 7,20). В водных растворах сульфит-ионы бесцветны, подвергаются гидролизу, являются сильными восстановителями (уже в водных растворах они медленно окисляются кислородом воздуха до сульфатов). Однако некоторые сильные восстановители, например, металлический цинк в кислой среде, могут восстанавливать сульфиты до сероводорода H2S. Сульфит-ион обладает довольно эффективными комплексообразующими свойствами как лиганд. Средние сульфиты натрия и калия хорошо растворяются в воде, средние сульфиты других металлов, как правило, малорастворимы в воде. При действии кислот на сульфиты они разлагаются. Реакция с хлоридом бария (фармакопейная). Сульфит-ионы при взаимодействии с катионами бария образуют белый кристаллический осадок сульфита бария BaS03: Ba2++S032- = BaS03 Осадок растворяется в разбавленных НСI и HN03 с выделением газообразного диоксида серы S02, например: BaS03 + 2НС1 -> S02 + ВаС12 + Н20 Аналогично протекает реакция сульфит-ионов и с хлоридом стронция SrCl2. Методика. В пробирку вносят 2—3 капли раствора сульфита натрия Na2S03 и прибавляют 2—3 капли раствора ВаС12. Выпадает белый осадок сульфита бария. К полученной смеси прибавляют по каплям раствор НС1. Осадок растворяется. Реакция разложения сульфитов кислотами (фармакопейная). Все сульфиты разлагаются минеральными кислотами с выделением газообразного диоксида серы S02: S032-+2H+ ->S02+H20 Выделяющийся диоксид серы обнаруживают по характерному запаху, а также по обесцвечиванию водного раствора иода или перманганата калия:
S02 +12 + 2Н20 -> H2S04 + 2HI 5S02 + 2KMn04 + 2Н20 -> K2S04 + 2MnS04 + 2H2S04 Разложение сульфитов под действием кислот ускоряется при нагревании и при понижении рН среды. Реакцию обычно проводят в приборе для обнаружения газов (рис. 16.1), состоящем из двух пробирок (7 и 2). Одна пробирка 1 снабжена пробкой с газоотводной изогнутой стеклянной трубкой, свободный конец которой погружают в раствор (для поглощения выделяющегося газа), которым заполняется другая пробирка-приемник 2. Методика. Первый вариант. В пробирку 1 с пробкой вносят 6—8 капель раствора сульфита натрия, быстро прибавляют 6—8 капель разбавленной H2S04, сразу же закрывают пробирку пробкой с газоотводной трубкой, свободный конец которой погружают в пробирку-приемник 2, заполненную сильно разбавленным (светло-розового цвета) раствором перманганата калия, подкисленным серной кислотой. Розовый раствор в пробирке-приемнике обесцвечивается. Второй вариант. В пробирку вносят 5—6 капель раствора сульфита натрия, прибавляют столько же капель раствора НС1 или H2S04 и встряхивают пробирку с раствором. Постепенно выделяется газообразный диоксид серы с характерным запахом. Реакция с нитратом серебра. Сульфит-ионы дают с нитратом серебра AgN03 белый осадок сульфита серебра Ag2S03, растворимый при избытке сульфит-ионов с образованием растворимых комплексных дисульфитоаргентат(I)-ионов [Ag(S203)2]3-: 2Ag++S032- ->Ag2S03 Ag2S03 +3S032- -> 2[Ag(S03)2]3- При кипячении смеси белый осадок сульфита серебра темнеет за счет выделения оксида серебра Ag20: Ag2S03 -> Ag20 + S02 Методика. В пробирку вносят 2—3 капли раствора сульфита натрия и по каплям прибавляют раствор нитрата серебра до выпадения белого осадка сульфита серебра. К образовавшейся смеси по каплям при перемешивании прибавляют раствор сульфита натрия до растворения осадка. В другой пробирке аналогично получают белый осадок сульфита серебра и кипятят смесь осадка с раствором. Осадок постепенно становится бурым. Реакция с перманганатом калия. Сульфит-ион при реакции с пер-манганатом калия КМn04 в кислой среде окисляется до сульфат-ионов: 5S032- +2МnО4- +6Н+ = 2Mn2+ +5S042- +ЗН20
При этом розовый раствор перманганата калия обесцвечивается. В нейтральной среде сульфит-ион при реакции с перманганат-ионом также окисляется до сульфат-иона. Одновременно образуется темный хлопьевидный осадок МпО(ОН)2: 3S032- + 2МnО4- + ЗН20 -> 2МnО(ОН)2 + 3S042- + 20Н- Методика. В каждую из двух пробирок вносят по 2—3 капли раствора сульфита натрия. В одну пробирку прибавляют 2—3 капли раствора H2S04 и по каплям — сильно разбавленный (до светло-розовой окраски) раствор перманганата калия. Раствор обесцвечивается. В другую пробирку добавляют по каплям такой же раствор перманганата калия. Выпадает темный хлопьевидный осадок МnО(ОН)2. Реакция с раствором иода (фармакопейная). Сульфит-ионы в нейтральных или слабо кислых растворах окисляются иодом до сульфат-ионов. При этом желтый раствор иода обесцвечивается вследствие восстановления иода до иодид-ионов: SO32- +12 + Н20 = SO42- + 2I- + 2Н+ Аналогично протекает реакция сульфит-иона с бромной водой. Методика. а) В пробирку вносят 2—3 капли раствора сульфита натрия, прибав- б) В пробирку вносят 2—3 капли раствора сульфита натрия и добав- Реакция восстановления сульфит-иона металлическим цинком в кислой среде. Сульфит-ион восстанавливается металлическим цинком в кислой среде до сероводорода H2S. Реакцию можно описать схемой: S032- +2H+ = S02+H20 S02 +3Zn + 6H+ = H2S+3Zn2+ +2H20 Выделяющийся газообразный сероводород можно обнаружить по почернению фильтровальной бумаги, смоченной раствором соли свинца(II), вследствие образования черного сульфида свинца PbS: H2S + Pb2+ = PbS+2H+ Методика. В пробирку вносят 3—4 капли раствора сульфита натрия, прибавляют 2 капли раствора НС1 и немного металлического цинка. В верхнюю часть пробирки помещают полоску фильтровальной бумаги, смоченной раствором соли свинца. Бумага чернеет. Аналитические реакции тиосульфат-иона S2O32- Тиосульфат-ион S2O32- — анион неустойчивой двухосновной тиосерной кислоты H2S203 средней силы (рК1 = 0,60, рК2 = 1,72), которая в водных растворах разлагается с выделением элементной серы: H2S203 = S + S02 + H20
В водных растворах тиосульфат-ион бесцветен, практически не гидроли-зуется, является сильным восстановителем и достаточно эффективным лигандом-комплексообразователем. Тиосульфаты щелочных металлов, стронция, цинка, кадмия, марган-ца(II), железа(II), кобальта(II), никеля(II) растворимы в воде. Тиосульфаты других металлов малорастворимы в воде. Реакция с хлоридом бария. Тиосульфат-ион при взаимодействии с катионами бария образует белый мелкокристаллический осадок тиосульфата бария: Ba2++S2032- = BaS203 осадок растворяется в кислотах с разложением: BaS203 +2h+ = Ba2++S+S02+h20 Методика. В пробирку вносят 2—3 капли раствора тиосульфата натрия Na2S203 и прибавляют 2—3 капли раствора хлорида бария. Выпадает белый осадок тиосульфата бария. Осадок образуется медленно. Для ускорения выделения осадка можно потереть внутреннюю стенку пробирки стеклянной палочкой. Реакция разложения тиосульфатов кислотами (фармакопейная). При действии минеральных кислот на тиосульфаты вначале образуется нестабильная тиосерная (серноватистая) кислота H2S203, быстро разлагающаяся с выделением газообразного диоксида серы S02 и элементной серы S, которая вызывает помутнение раствора: S2032-+2h+ = H2S203 H2S2O3 = S+SO2+Н20 Выделяющийся газообразный диоксид серы обнаруживают либо по характерному запаху, либо по обесцвечиванию им растворов перманганата калия или иода. Методика а) В пробирку вносят 3—4 капли раствора тиосульфата натрия и б) Реакцию проводят с использованием прибора для обнаружения га- В пробирку 1 вносят 6—8 капель раствора тиосульфата натрия и 6—8 капель разбавленного раствора НС1. Пробирку сразу же закрывают пробкой с газоотводной трубкой, свободный конец которой погружают в сильно разбавленный раствор КМn04 (бледно-розового цвета) или в сильно разбавленный раствор иода (бледно-желтого цвета), находящийся в пробирке-приемнике 2. Раствор в первой пробирке мутнеет вследствие выделения элементной серы. Раствор в пробирке-приемнике обесцвечивается. Реакция с иодом. Тиосульфат-ион обесцвечивает нейтральные или слабо щелочные растворы иода, восстанавливая иод до иодид-ионов I- с одновременным образованием тетратионат-иона S4062-: 2S2032- + I2 = S4062- + 2I- Эта реакция имеет большое значение в количественном титриметри-ческом анализе. Методика. В пробирку вносят 3—4 капли разбавленного раствора иода, имеющего желтую окраску, и прибавляют по каплям раствор тиосульфата натрия до обесцвечивания раствора иода. Реакция с нитратом серебра (фармакопейная). Тиосульфат-ион с катионами серебра Ag+ образует белый осадок тиосульфата серебра Ag2S203: 2Ag++S2032- = Ag2S203 Осадок тиосульфата серебра быстро разлагается до черного сульфида серебра(1) Ag2S. Цвет осадка последовательно изменяется на желтый, бурый и под конец — на черный. Реакция протекает по схеме: Ag2S203 + Н20 = Ag2S + H2S04 При избытке тиосульфат-ионов осадок тиосульфата серебра растворяется с образованием комплексных дитиосульфатоаргентат(1)-ионов [Ag(S20)2]3-: Ag2S203 + 3S2032- = 2[Ag(S203)2]3- Методика. В пробирку вносят 2—3 капли раствора тиосульфата натрия и прибавляют 2—3 капли раствора нитрата серебра AgN03. Выделяется белый осадок тиосульфата серебра, постепенно изменяющий окраску на буро-черную. В другой пробирке аналогично получают белый осадок тиосульфата серебра и сразу же прибавляют к нему при перемешивании избыток раствора тиосульфата натрия до растворения осадка. Реакция с сульфатом меди(II). Тиосульфат-ион при взаимодействии с катионами меди(1Г) Си2+ образует черный осадок сульфида меди(I) Cu2S: 2Cu2+ + 3S2032- = Cu2S203 + S4062- Cu2S203 + H20 = Cu2S + H2S04 Методика. В пробирку вносят 2—3 капли раствора тиосульфата натрия, прибавляют 2—3 капли раствора сульфата меди(II) CuS04 и осторожно нагревают пробирку. Выпадает черный осадок сульфата меди(I). Аналитические реакции оксалат-иона С2042- Оксалат-ион С2042- — анион двухосновной щавелевой кислоты Н2С204 средней силы (рК1 = 1,25; рК2 = 4,27), сравнительно хорошо растворимой в воде. Оксалат-ион в водных растворах бесцветен, частично гидролизуется, сильный восстановитель, эффективный лиганд — образует устойчивые оксалатные комплексы с катионами многих металлов. Оксалаты щелочных металлов, магния и аммония растворяются в воде. Оксалаты других катионов, как правило, малорастворимы в воде. Реакция с хлоридом бария. Соли бария осаждают из водных растворов оксалат-ион в виде белого осадка оксалата бария ВаС204: Ва2++С2O42- = ВаС204 Осадок оксалата бария растворяется в минеральных кислотах, а при кипячении — ив уксусной кислоте. Методика. В каждую из двух пробирок вносят по 2—3 капли раствора оксалата аммония (NH4)2C204 и прибавляют по 2—3 капли раствора бария хлорида. В обеих пробирках выпадает белый осадок оксалата бария. В одну пробирку прибавляют по каплям при перемешивании раствор НСl до полного растворения осадка. В другую пробирку прибавляют 6—7 капель раствора уксусной кислоты и осторожно нагревают смесь до кипения. При кипячении смеси осадок постепенно растворяется. Аналогично протекает реакция оксалат-ионов с катионами кальция (фармакопейная) с образованием белого осадка оксалата кальция СаС204, который растворяется в минеральных кислотах, но не растворяется в уксусной кислоте. Реакция с нитратом серебра. Оксалат-ионы при взаимодействии с катионами серебра Ag+ образуют белый творожистый осадок оксалата серебра Ag2C204: 2Ag++C2O42- = Ag2C204 Осадок оксалата серебра растворяется в азотной кислоте, в концентрированном растворе аммиака. Действие раствора НС1 на оксалат серебра приводит к образованию хлорида серебра: Ag2C204+2HCl = 2AgCl + H2C204
Методика В каждую из трех пробирок вносят по 2—3 капли раствора оксалата аммония (NH4)2C204 и прибавляют по 2—3 капли раствора AgN03. В каждой пробирке выпадает белый осадок оксалата серебра. В одну пробирку прибавляют по каплям при перемешивании раствор HN03 до растворения осадка. В другую пробирку также по каплям при перемешивании добавляют концентрированный раствор аммиака до растворения осадка. В третью пробирку прибавляют 4—5 капель раствора НС1; в пробирке остается белый осадок хлорида серебра. Реакция с перманганатом калия. Оксалат-ионы при взаимодействии с перманганатом калия КМnO4 в кислой среде при нагревании окисляются с выделением газообразного диоксида углерода С02; раствор перманганата калия при этом обесцвечивается вследствие восстановления марганца(VII) до марганца(II): 5С2O42- + 2МnО4- + 16Н+ = 10СО2 + 2Мn2+ +8Н20 При проведении этой реакции можно использовать прибор для обнаружения газов, аналогичный тому, который применяется при изучении реакции разложения сульфитов кислотами (см. рис. 16.1). Методика. а) В пробирку вносят 2—3 капли раствора оксалата аммония, б) В пробирку 1 (см. рис. 16.1) вносят 6—8 капель раствора оксалата перманганат-ионов. Пробирку 1 закрывают пробкой с газоотводной трубкой, погружая ее свободный конец в раствор баритовой воды (насыщенный раствор гидро-ксида бария Ва(ОН)2) или известковой воды (насыщенный раствор гид-роксида кальция Са(ОН)2), находящийся в другой пробирке-приемнике 2. Осторожно нагревают раствор в первой пробирке до ~70—80 °С. При нагревании раствор обесцвечивается и из него выделяются пузырьки газа (С02), который через газоотводную трубку попадает в пробирку-приемник 2 и вызывает помутнение известковой воды вследствие образования малорастворимого карбоната кальция СаС03: Са2+ + 20Н- + С02 = СаС03 + Н20
Аналитические реакции карбонат-иона СО32- Карбонаты — соли нестабильной очень слабой угольной кислоты Н2С03 (pK1 = 6,35, рК2 = 10,32), которая в свободном состоянии в водных растворах неустойчива и разлагается с выделением диоксида углерода С02: Н2СО3 = СО2+Н2О Угольная кислота образует два ряда солей: средние карбонаты (или просто карбонаты), содержащие анион СО3 2-, и гидрокарбонаты, содержащие анион HCO3- . Карбонаты аммония, натрия, калия, рубидия, цезия растворимы в воде. Карбонат лития в воде малорастворим. Карбонаты других металлов, как правило, также малорастворимы в воде. Гидрокарбонаты растворяются в воде. Карбонат-ионы в водных растворах бесцветны, не обладают ни окислительными, ни восстановительными свойствами, способны как ли-ганды к образованию различных по устойчивости карбонатных комплексов с катионами ряда металлов. Карбонат-ионы в водных растворах подвергаются гидролизу. Водные растворы гидрокарбонатов щелочных металлов не окрашиваются при прибавлении к ним капли раствора фенолфталеина, что позволяет отличать растворы карбонатов от растворов гидрокарбонатов (фармакопейный тест). Реакция с хлоридом бария. Карбонат-ион при взаимодействии с катионами бария образует белый мелкокристаллический осадок карбоната бария ВаС03: Ва2++СО32- = ВаС03 Осадок растворяется в минеральных кислотах (в растворе H2S04 образуется белый осадок BaS04) и в уксусной кислоте. Аналогичные осадки карбонатов дают катионы кальция (СаС03) и стронция (SrC03). Методика. В пробирку вносят 2—3 капли раствора карбоната натрия Na2C03 и прибавляют 2—3 капли раствора хлорида бария. Выпадает белый осадок карбоната бария. К осадку медленно, по каплям прибавляют раствор НС1 до полного растворения осадка. Реакция с сульфатом магния (фармакопейная). Карбонат-ион СО32- с сульфатом магния образует белый осадок карбоната магния MgC03: Mg2++C032- = MgC03 Осадок карбоната магния растворяется в кислотах. Гидрокарбонат-ион НС03 образует с сульфатом магния осадок MgC03 только при кипячении: Mg2+ + 2НСО3- = MgC03 + С02 + Н2О Методика. В пробирку вносят 3—5 капель раствора карбоната натрия Na2C03 и прибавляют столько же капель насыщенного раствора сульфата магния MgS04. Выпадает белый осадок карбоната магния. Реакция с минеральными кислотами (фармакопейная). Карбонат-ионы и гидрокарбонат-ионы при взаимодействии с кислотами образуют слабую нестабильную угольную кислоту, быстро разлагающуюся в кислой среде с выделением газообразного диоксида углерода СO2: СО32- + 2Н30+ = Н2С03 + 2Н2O HCO- + Н3О+ = Н2СО3 + Н2O Н2С03 ->С02+Н20 Выделяющийся газообразный диоксид углерода обнаруживают по помутнению баритовой или известковой воды в приборе для обнаружения газов (см. рис. 16.1). Методика. В пробирку 1 вносят 8—10 капель раствора карбоната натрия Na2C03 или гидрокарбоната натрия NaHC03, прибавляют столько же капель раствора НС1 или H2S04 и сразу же закрывают пробирку 1 пробкой с газоотводной трубкой, свободный конец которой быстро погружают в баритовую или известковую воду, находящуюся в пробирке-приемнике 2. В первой пробирке наблюдается выделение пузырьков газа (С02), в пробирке-приемнике — помутнение раствора. Реакция с гексацианоферратом(II) уранила. Карбонат-ионы обесцвечивают коричневый раствор гексацианоферрата(II) уранила (U02)2[Fe(CN)6], разлагая его на бесцветный карбонат уранила U02C03 (или на карбонатные комплексы уранила) и ферроцианид-ионы [Fe(CN)6]4-, которые в малых концентрациях не придают раствору интенсивной окраски. Реакция протекает по схеме: 2С032- + (U02)2[Fe(CN)6] -> 2U02C03 +[Fe(CN)6]4- Коричневый раствор тексацианоферрата(П) уранила получают, смешивая раствор ацетата уранила (CH3COO)2U02 с раствором гексацианоферрата(II) калия:
2(CH3COO)2U02+K4[Fe(CN)6] = (U02)2[Fe(CN)6] + 4CH3COOK Реакция — высокочувствительная: предел обнаружения равен 0,4 мкг. Методика. В пробирку вносят 3—4 капли раствора ацетата уранила и прибавляют 2—3 капли раствора гексацианоферрата(II) калия. Раствор окрашивается в коричневый цвет вследствие образования гексациано-феррата(II) уранила. К полученному раствору прибавляют по каплям раствор Na2C03 или К2С03 при перемешивании до исчезновения коричневой окраски. Раздельное открытие карбонат-ионов и гидрокарбонат-ионов реакциями с катионами кальция и с аммиаком. Если в растворе одновременно присутствуют карбонат-ионы СО32- и гидрокарбонат-ионы HCO3-, то каждый из этих анионов можно открыть раздельно. Для этого вначале к анализируемому раствору прибавляют избыток раствора хлорида кальция. При этом карбонат-анионы СО32- осаждаются в виде карбоната кальция СаС03: СО2 +Са2+ = СаС03 Гидрокарбонат-анионы НС03 остаются в растворе, так как Са(НС03)2 растворим в воде. Осадок СаС03 отделяют от раствора и к последнему прибавляют раствор аммиака. Гидрокарбонат-анионы с аммиаком и катионами кальция дают снова осадок карбоната кальция: HCO3- + Са2+ +NH3 = СаС03 + NH4+ Методика. В пробирку вносят 6—8 капель раствора гидрокарбоната натрия NaHC03, одну каплю раствора карбоната натрия Na2C03 и прибавляют 4—5 капель раствора СаС12. Выпадает белый осадок карбоната кальция СаС03, который отделяют от раствора центрифугированием. К центрифугату добавляют по каплям раствор аммиака до прекращения выделения белого осадка карбоната кальция. Аналитические реакции борат-ионов В4O72- и ВO2-. Тетраборат-ион В4O72- — анион слабой двухосновной тетраборной кислоты Н2В407 (pK1=3,74, pK2=7,70), которая в свободном (индивидуальном) состоянии неизвестна, но может существовать в растворах. Тетраборат-ион в водных растворах бесцветен, подвергается глубокому гидролизу, не проявляет окислительно-восстановительных свойств, не обладает выраженной комплексообразующей способностью как лиганд. Метаборат-ион В02- (часто называемый просто «борат-ионом») — анион (по составу) не существующей в растворах метаборной кислоты НВ02. Однако в свободном индивидуальном состоянии метаборная кислота существует в виде трех кристаллических модификаций. Как и тетраборат-ион, метаборат-ион в водных растворах бесцветен, подвергается гидролизу, индифферентен как окислитель и восстановитель; обладает умеренной комплексообразующей способностью как лиганд. Истинное строение и состав метаборат-иона в растворе неизвестны. Применяемая на практике борная кислота — это трехосновная ор-тоборная кислота Н3ВО3, которую можно также описать формулой В(ОН)3. Борная кислота хорошо растворяется в воде и в водных растворах является очень слабой кислотой (pK1 = 9,15, рК2 = 12,74, рКъ = 13,80), поэтому в кислых средах она практически полностью присутствует в не-диссоциированной форме Н3В03. В водных растворах тетра-, орто- и метаборная кислоты находятся в равновесии: Н2В407+5Н20 ↔ 4Н3В03 ↔ 4НВ02+4Н20 Ортоборная кислота не образует соли с катионами металлов, но дает со спиртами сложные эфиры, например (СН30)3В, (С2Н50)3В и т. д. Мета-и тетраборная кислоты образуют соли — бораты, анионы которых содержат соответственно метаборат-анион В02- и тетраборат-анион В4O72-. Бораты аммония и щелочных металлов растворимы в воде. Бораты других металлов, как правило, малорастворимы в воде. Из боратов наибольшее практическое значение имеет декагидрат тетрабората натрия Na2B4O7*10H2O — белое кристаллическое вещество, обычно называемое бурой. Бура применяется в качественном анализе для открытия металлов по образованию окрашенных плавов —«перлов» буры, а также в количественном титриметрическом анализе как первичный стандарт, по которому стандартизуют растворы кислот. Метабораты всегда содержат кристаллизационную воду, поэтому иногда полагают, что они на самом деле являются кислыми солями орто-борной кислоты. Например, двухводному борату кальция Са(В02)2*2Н20 приписывают формулу Са(Н2В03)2. Реакция с хлоридом бария. Борат-ионы при взаимодействии с хлоридом бария в водных растворах образуют белый кристаллический осадок метабората бария Ва(В02)2: В4O72- + Ва2+ + ЗН20 → Ва(В02 )2 + 2Н3В03 Осадок растворяется в азотной и уксусной кислотах. Методика. В пробирку вносят 3—4 капли раствора буры и прибавляют по каплям раствор ВаС12 до прекращения образования белого осадка метабората бария. Окрашивание пламени горелки сложными эфирами борной кислоты (фармакопейный тест). Борат-ионы или борная кислота образуют с этанолом С2Н5ОН в присутствии серной кислоты сложный этиловый эфир борной кислоты (С2Н50)3В, который окрашивает пламя в зеленый цвет. Реакцию образования сложных эфиров борной кислоты можно описать схемой:
В4О72- + 2Н+ + 5Н20 = 4Н3В03 Н3В03 + ЗС2Н5ОН = (С2Н5O)3 В + ЗН2O Аналогичные продукты реакции борная кислота и бораты дают с глицерином, метанолом и другими спиртами. Методика. В фарфоровую чашку или в микротигель помещают 4—6 капель раствора буры и выпаривают раствор досуха. К сухому остатку после его охлаждения до комнатной температуры прибавляют 2—3 капли концентрированной серной кислоты и 5—6 капель этанола. Смесь перемешивают и поджигают. Пламя окрашивается в зеленый цвет. Реакция с куркумином (фармакопейная). Борная кислота и бораты при взаимодействии с красителем куркумином в кислой среде образуют куркуминовый комплекс розового или темно-красного цвета (в зависимости от концентрации борной кислоты), который в щелочной или аммиачной среде изменяет окраску на зеленовато-черную или синевато-черную.
кетонная форма енольная форма
Щелочные растворы куркумина имеют красно-коричневый цвет, кислые — светло-желтый. При реакции куркумина с борной кислотой (в кислой среде бораты образуют борную кислоту) образуется куркумино-вый комплекс бора. Некоторые исследователи полагают, что в реакции комплексообразования участвует енольная форма куркумина и образуется куркуминовый комплекс бора — розоцианин красного цвета. Другие исследователи считают, что в реакцию образования красного куркуминового комплекса вступает кетонная таутомерная форма куркумина Реакцию проводят обычно с помощью куркумовой бумаги. Ее готовят, пропитывая белую плотную фильтровальную бумагу спиртовым раствором куркумина (спиртовой настойкой куркумы) и затем высушивая ее в защищенном от света месте в атмосфере, не содержащей паров кислот и аммиака. Методика. В пробирку вносят 4—6 капель раствора буры, 2—3 капли раствора НС1. В этот раствор погружают высушенную куркумовую бумагу, выдерживают около одной минуты и высушивают. Желтая окраска куркумина изменяется на темно-красную или коричневую — цвет комплекса. Бумагу смачивают раствором аммиака; цвет бумаги изменяется на зеленовато-черный или синевато-черный. Некоторые другие реакции борат-ионов. В качественном анализе используют реакцию получения перлов буры: при плавлении буры образуется прозрачная стекловидная масса — «перлы буры». Если плавить смесь буры с солями металлов, то образуются окрашенные перлы, цвет которых зависит от природы катиона металла. Борная кислота образует комплексные кислоты с глицерином и ман-нитом; с рядом других органических реагентов, содержащих гидроксиль-ные группы (ализарин, хинализарин, пурпурин, хромотроп 2В и др.), в кислой среде — окрашенные комплексы. Аналитические реакции ортофосфат-ионов. Фосфат-ион Р043-,гидрофосфат-ион НР04-, дигидрофосфат-ион Н2Р04 — анионы трехосновной ортофосфорной кислоты Н3Р04, которая по первой стадии диссоциации является кислотой средней силы (pК1 = 2,15), а по второй и третьей — очень слабой кислотой (рК2 = 7,21, рK3 = 12,30). Известны многочисленные фосфаты — соли разных фосфорных кислот. Обычно к фосфатам относят соли ортофосфорной кислоты Н3Р04 (ортофосфаты), пирофосфорной кислоты Н4Р207 (пирофосфаты или ди-фосфаты), а также многочисленные конденсированные полифосфаты различного состава и строения (метафосфаты, например, метафосфат калия состава КР03, триполифосфаты, тетраполифосфаты и т. д.). В фармацевтическом анализе чаще других встречаются анионы ортофосфорной кислоты — средний ортофосфат-ион Р043-, обычно называемый просто «фосфат-ион», гидрофосфат-ион НР04- и дигидрофосфат-ион Н2Р04. Другие фосфат-ионы играют меньшую роль в фармацевтическом анализе. Поэтому в дальнейшем рассмотрим только реакции среднего и кислых ортофосфат-ионов. Эти анионы в водных растворах бесцветны и подвергаются гидролизу, не проявляют окислительно-восстановительных свойств, образуют с катионами металлов многочисленные устойчивые фосфатные комплексы. Ортофосфаты аммония и щелочных металлов, а также дигидрофосфаты щелочно-земельных металлов растворимы в воде. Ортофосфаты других металлов, как правило, малорастворимы в воде, но обычно растворяются в минеральных кислотах и в уксусной кислоте (кроме FeP04, А1Р04, CrP04, РЬ3(Р04)2, которые в уксусной кислоте не растворяются). Фосфат висмута(III) BiP04 малорастворим в разбавленной азотной кислоте. Реакция с хлоридом бария. Средний ортофосфат-ион Р043- с катионами бария образует белый осадок среднего ортофосфата бария Ва3(Р04)2: 2Р043- + ЗВа2+ → Ва3(Р04)2 Гидрофосфат-анион НРО42- с катионами бария дает белый осадок гидрофосфата бария ВаНР04: НРO42- + Ва2+ → ВаНР04 В аммиачной среде реакция гидрофосфат-ионов с катионами бария приводит к образованию осадка среднего ортофосфата бария Ва3(Р04)2: 2НРO42- + ЗВа2+ +2NH3 → Ba3(P04)3 +2NH4+ Свежеосажденный осадок среднего ортофосфата бария растворяется в HN03, НС1, СН3СООН. Методика. В пробирку вносят 4—6 капель раствора гидрофосфата натрия Na2HP04, 2—3 капли раствора аммиака и прибавляют по каплям раствор хлорида бария до прекращения образования белого осадка среднего ортофосфата бария. Реакция с нитратом серебра (фармакопейная). Средний ортофосфат-ион Р043- или гидрофосфат-ион НРО42- образует с катионами серебра в нейтральной среде желтый осадок фосфата серебра Ag3P04: P043-+3Ag+ → Ag3P04 HРО42- + 3Ag+ → Ag3P04 +Н+ Осадок растворяется в азотной кислоте, в концентрированном аммиаке. Методика. В пробирку вносят 4—5 капель раствора фосфата или гидрофосфата натрия и прибавляют по каплям раствор AgN03 до прекращения выделения желтого осадка фосфата серебра. Реакция с магнезиальной смесью (фармакопейная). Гидрофосфат-ион НР04- при взаимодействии с магнезиальной смесью (MgCl2 + NH4C1 + NH3), получаемой смешиванием водных растворов хлорида магния, хлорида аммония и аммиака, образует белый мелкокристаллический осадок маг-нийаммонийфосфата NH4MgP04: НРО42- + Mg2+ + NH3 → NH4MgP04 Осадок магнийаммонийфосфата растворяется в кислотах. Методика. а) В пробирку вносят 3—4 капли раствора Na2HP04, прибавляют столько же капель раствора магнезиальной смеси и перемешивают содержимое пробирки. Образуется белый кристаллический осадок магнийаммонийфосфата. б) В пробирку вносят 2—3 капли раствора Na2HP04, прибавляют по 2'капли растворов NH4CI и NH3, одну каплю раствора MgS04. Выпадает белый кристаллический осадок магнийаммонийфосфата. Реакция с молибдатом аммония (фармакопейная). Ортофосфат-ионы при взаимодействии с молибдатом аммония (NH4)2MoO4 в азотнокислой среде при нагревании образуют желтый кристаллический осадок комплексной аммонийной соли фосфоромолибденовой гетерополикислоты — фосфо-ромолибдат аммония (NH4)3[P04(MoO3)i2] (или (NH4[PMo12O40]): Р043- +3NH+ +12МоO2- + 24Н+ → (NH4)3[PO4(Mo03)12] + 12H20 Иногда эту реакцию описывают схемой: Р043- + 3NH4+ + 12МоO42- + 24Н+ → (NH4)3H4[P(Mo2O7)6] + 10Н2О по которой осадку приписывают состав кислой аммонийной соли фосфоромолибденовой гетерополикислоты Н7[Р(Мо207)6]. Осадок фосфоромолибдата аммония растворяется в HN03, в растворах щелочей и аммиака. Он также растворим в присутствии большого количества фосфат-ионов с образованием желтого раствора, поэтому реакцию проводят при избытке молибдата аммония, чтобы перевести в комплексную соль все фосфат-ионы. При недостатке молибдата аммония осадок не выделяется, но раствор сохраняет желтый цвет. Чувствительность реакции повышается при добавлении в раствор кристаллического нитрата аммония NH4N03. Считается, что рассматриваемая реакция является наилучшей для открытия фосфат-ионов при отсутствии арсенат-ионов, дающих аналогичный эффект. Мешают также анионы-восстановители SO32-, S2032-, S2- и др., восстанавливающие комплексный гетерополианион до молибденовой сини состава Мо2O5Мо2O3*6Н2O. Методика. а) В пробирку вносят 1—2 капли раствора гидрофосфата натрия б) В пробирку вносят 1—2 капли раствора гидрофосфата натрия, Иногда реакцию с молибдатом аммония проводят в присутствии бензидина — появляется синее окрашивание. Присутствие бензидина повышает чувствительность реакции (предел обнаружения 0,05 мкг, предельное разбавление равно 106 мл/г). Другие реакции фосфат-ионов. Фосфат-ионы вступают в реакции с многочисленными реагентами, однако только немногие из этих реакций имеют аналитическое значение. В основном — это реакции, описанные выше. Аналитические реакции арсенит-иона AsO33-. Арсенит-ион AsO33- — анион слабой трехосновной ортомышьяковистой (или просто мышьяковистой) кислоты H3AsO3, (pK1 = 9,23), которая в свободном (индивидуальном) состоянии неизвестна и может существовать только в растворах. В водных растворах, как полагают, устанавливается равновесие: H3As03 ↔ HAsO2+H2O смещенное в обычных условиях вправо — в сторону образования слабой одноосновной метамышъяковистой кислоты HAsO2. Поэтому приведенное выше значение рК1 = 9,23 можно относить как к первой стадии диссоциации ортомышьяковистой кислоты, так и к диссоциации метамышь- яковистой кислоты, а арсенит-ионом можно считать как анион AsO33-, так и анион As02-. Большинство арсенитов— производные метамышъяковистой кислоты (содержат по составу анион AsO22- ). Арсенит-ионы в водных растворах бесцветны, гидролизуются, обладают восстановительными свойствами. Комплексные соединения металлов, содержащие арсенит-ионы в качестве лигандов, малоизучены. Большинство арсенитов малорастворимы в воде. Арсениты аммония, щелочных металлов и магния — растворяются в воде. Соединения мышьяка токсичны! При работе с ними необходимо проявлять особую осторожность! Реакция с хлоридом бария. Арсенит-ионы в аммиачной среде при взаимодействии с катионами бария образуют белый осадок арсенита бария Ba3(As03)2: 2As033- + ЗВа2+ → Ba3(AsO3)2 Методика. В пробирку вносят 2—3 капли раствора арсенита натрия Na3AsO3, 2 капли раствора аммиака и добавляют но каплям раствор ВаС12 до прекращения образования белого осадка арсенита бария. Реакция с сульфид-ионами в кислой среде (фармакопейная). Арсенит-ионы при реакциях с растворимыми сульфидами (натрия, аммония) образуют желтый осадок сульфида мышьяка(III) As2S3 только в сильнокислой среде:
2H3As03 + 3H2S → As2S3 + 6Н20 Из нейтральных или щелочных растворов осадок не выпадает. Осадок As2S3 нерастворим в НС1, но растворяется в растворах щелочей, аммиака, карбоната аммония при избытке сульфидов аммония или натрия с образованием тиосолей, например: As2S3 + 6NaOH → Na3AsS3 + Na3AsO3 + 3H20 As2S3 +6NH3*H2O → (NH4)3AsS3 + (NH4)3As03 +3H20 As2S3 + 6(NH4)2C03 +3H20 → (NH4)3AsS3 + (NH4)3 As03 + 6NH4HC03 As2S3 + 3(NH4 )2 S → 2(NH4 )3 AsS3 Методика. В пробирку вносят 3—4 капли раствора арсенита натрия Na3As03, 4—5 капель раствора НС1 и по каплям добавляют раствор сульфида натрия Na2S или сероводородной воды. Выпадает желтый осадок сульфида мышьяка(III). Реакция с. нитратом серебра (фармакопейная). Арсениты образуют с нитратом серебра AgN03 желтый аморфный осадок арсенита серебра Ag3As03: AsO33- + 3Ag+ → Ag3As03 Осадок растворяется в HN03 и в аммиаке: Ag3As03 + 3HN03 → 3AgN03 + H3As03 Ag3As03 +6NH3 → 3[Ag(NH3)2]+ + AsO33- Методика. К 3—5 каплям раствора арсенита натрия Na3As03 прибавляют по каплям раствор AgN03. Выпадает желтый осадок. Реакция с иодом. Арсениты окисляются иодом I2 до арсенатов в нейтральной или слабощелочной среде (раствор иода обесцвечивается): AsO33- + I2 + H20 ↔ As043- + 2I- + 2H+ Реакция обратима. Для смещения равновесия вправо в раствор прибавляют твердый гидрокарбонат натрия NaHC03, связывающий ионы водорода в слабую угольную кислоту. Аналогично протекают реакции с хлорной и бромной водой, которые окисляют арсениты до арсенатов. Методика. В пробирку вносят 3—5 капель раствора Na3As03, прибавляют небольшое количество твердого гидрокарбоната натрия NaHC03 и добавляют по каплям раствор иода, который обесцвечивается. Реакция с солями меди(II). Арсениты или мышьяковистая кислота при реакциях с солями меди(II) в слабощелочной среде образуют желто-зеленый осадок арсенита меди Cu3(As03)2:
2AsO33- + 3Cu2+ → Cu3(As03)2 Осадок растворяется в избытке щелочи. При этом раствор окрашивается в синий цвет: Cu3(As03)2+12NaOH → 3Na2Cu02 + 2Na3As03 + 6Н20 синий При кипячении этого синего щелочного раствора мышьяк(Ш) окисляется медью(II) до мышьяка(V) и из раствора выпадает красный осадок оксида меди(I) Cu20: 2Na2Cu02 + Na3As03 + 2Н20 → Cu20 + Na3As04 + 4NaOH Реакцию используют для отличия соединений мышьяка(III) от соединений мышьяка(V). Методика. В пробирку вносят 3—4 капли разбавленного раствора сульфата меди(II) CuS04, прибавляют 1—2 капли 2 моль/л раствора NaOH и 2 капли раствора арсенита Na3As03 или гидроарсенита Na2HAs03 натрия. Выпадает желто-зеленый осадок арсенита меди(II). К смеси добавляют по каплям при перемешивании раствор NaOH до растворения осадка и образования синего раствора. Последний осторожно нагревают до кипения и кипятят до прекращения выпадения красного осадка оксида меди(I). Реакция восстановления соединений мышьяка до арсина AsH3 (фармакопейная). Небольшие массы арсенитов, арсенатов или других соединений мышьяка (при содержании ~0,001—0,1 мг мышьяка) открывают очень чувствительной реакцией восстановления соединений мышьяка до газообразного арсина AsH3, который идентифицируют реакциями с нитратом серебра AgN03 или хлоридом ртути(II) HgCl2. Реакцию получения AsH3 проводят в кислой среде (H2S04 или НС1); восстановитель — часто металлический цинк (точнее — водород в момент выделения, образующийся при растворении металлического цинка в кислотах): AsO33- + 3Zn + 9Н+ → AsH3 + 3Zn2+ + 3H20 Вместо металлического цинка иногда используют металлический магний (а также алюминий — в щелочной среде). Выделяющийся газообразный арсин AsH3 при взаимодействии с AgN03 образует вначале соединение состава AsAg6(N03)3 желтого цвета: AsH3 +6AgN03 → AsAg6(N03)3 +3HN03 темнеющее затем вследствие разложения с выделением тонкодисперсного металлического серебра: AsAg6(N03)3 + ЗН20 → H3As03 + 6Ag + 3HN03 При взаимодействии AsH3 с хлоридом ртути(II) HgCl2 вначале образуется желто-оранжевый продукт реакции состава As(HgCl)3*Hg2Cl2, который под воздействием влаги изменяет окраску на бурую из-за разложения с выделением свободного мышьяка As (и Hg2Cl2). Мешают соединения сурьмы, фосфора, окислители. Арсин очень ядовит! Реакции проводят только под тягой! Методика. В чистую пробирку вносят ~1 мл раствора H2S04 (или ~10%-го раствора НС1), немного металлического цинка и прибавляют 3—4 капли разбавленного раствора Na3As03 (или Na2HAs04). Для поглощения возможных мешающих примесей сероводорода в верхнюю часть пробирки помещают вату, пропитанную раствором ацетата свинца (СН3СОО)2РЬ; при наличии сероводорода в парах вата чернеет за счет образования черного сульфида свинца. Отверстие пробирки покрывают фильтровальной бумагой, смоченной раствором AgN03. Через 3—4 мин после начала реакции на бумаге возникает бурое или черное пятно. Если вместо бумаги, пропитанной AgN03, использовать фильтровальную бумагу, смоченную спиртовым раствором HgCl2 (фармакопейная реакция), то на бумаге появится желто-бурое пятно. Другие реакции арсенит-иона. Арсениты при взаимодействии с хлоридом олова(II) в среде НС1 восстанавливаются и образуют черно-коричневый осадок свободного мышьяка. Аналитические реакции арсенат-иона AsO43-. Арсенат-ион As043- — анион трехосновной мышьяковой кислоты H3As04, сравнимой по силе с ортофосфорной кислотой. Для мышьяковой кислоты рK1 = 2,25, рК2 =6,77, рК3 = 11,53. Средние и кислые соли этой кислоты называются арсенатами. В водных растворах арсенат-ион бесцветен, гидролизуется, обладает умеренными окислительными свойствами в кислой среде, способен как лиганд к образованию координационных соединений металлов, однако арсенатные комплексы металлов малоизучены. Арсенаты большинства катионов малорастворимы в воде. Арсенаты щелочных металлов и аммония растворяются в воде. Все соединения мышьяка ядовиты! Реакция с хлоридом бария. Арсенат-ион As043- образует с катионами бария в аммиачной среде белый осадок арсената бария Ba3(As04)2: 2 As043- + ЗВа2+ → Ba3(As04)2 2HAs042- + ЗВа2+ +2NH3 → Ba3(As04)2 +2NH4+ Осадок арсената бария растворяется в минеральных кислотах и в уксусной кислоте. Методика. В пробирку вносят 3—5 капель раствора арсената натрия, 2 капли раствора аммиака и прибавляют по каплям раствор хлорида бария до прекращения выпадения белого осадка арсената бария. Реакция с нитратом серебра (фармакопейная). Арсенаты образуют с нитратом серебра AgN03 аморфный осадок арсената серебра Ag3As04 шоколадного цвета: As043- +3Ag+ → Ag3As04 Осадок растворяется в HN03, в концентрированном аммиаке: Ag3As04 +3HN03 → 3AgN03 + H3As04 Ag3As04 +6NH3 → 3[Ag(NH3)2]+ + As043- Методика. К 3—5 каплям раствора арсената натрия в пробирке прибавляют по каплям раствор AgN03 до выпадения осадка шоколадного цвета. Реакция с магнезиальной смесью (фармакопейная). Арсенат-ион с магнезиальной смесью (аммиачный раствор MgS04 и NH4C1) медленно образует белый мелкокристаллический осадок магнийаммонийарсената NH4MgAs04: As043- + NH4+ + Mg2+ → NH4MgAs04 Осадок растворяется в хлороводородной кислоте: NH4MgAs04 + ЗНС1 → NH4C1 + MgCl2 + H3As04 Мешают фосфат-ионы. С арсенит-ионами осадок не образуется. Методика. В пробирку вносят 3—5 капель раствора арсената натрия Na2HAs04 и такой же объем магнезиальной смеси (или же ~2—3 капли раствора MgS04, ~1—2 капли раствора аммиака и 4—5 капель раствора NH4CI). Пробирку встряхивают, стенки пробирки потирают стеклянной палочкой. Медленно образуется белый мелкокристаллический осадок. Реакцию можно проводить и как микрокристаллоскопическую. Реакция с сульфидами или сероводородной водой (фармакопейная). Арсенаты при взаимодействии с сульфид-ионами S2- в сильно кислой среде образуют желтый аморфный осадок сульфида мышьяка(V) As2S5: 2As043- + 5S2- +16Н+ → As2S5 +8Н20 Для смещения равновесия вправо реакцию проводят при большом избытке ионов водорода (в среде концентрированной НС1). Осадок растворяется в растворах (NH4)2S, аммиака, (NH4)2C03, в щелочах, в концентрированной азотной кислоте, но не растворяется в хлороводородной кислоте. Методика. В пробирку вносят 3—5 капель раствора арсената натрия, прибавляют 3—5 капель раствора концентрированной НС1 и вводят по каплям раствор сульфида аммония или сероводородную воду до выпадения желтого осадка. Реакция с молибдатом аммония. Арсенат-ионы образуют с молибдатом аммония (NH4)2Mo04 в азотнокислой среде (рН ≤ 1) при нагревании желтый кристаллический осадок аммонийной соли мышьяковомолибде-новой кислоты состава (NH4)3[As04(Mo03)12]: As043- +3NH4+ +12Мо042- +24Н+ → (NH4)3[As04(Mo03)12] + 12H20 Осадок растворяется в щелочах, но не растворяется в HN03. Мешают фосфат-ионы, дающие аналогичный осадок. Арсениты осадка не дают. Чувствительность реакции возрастает в присутствии NH4N03. Методика. Первый вариант. В микротигель вносят 3 капли раствора арсената натрия, содержимое тигля выпаривают досуха. К остатку прибавляют 3 капли концентрированной HN03 и упаривают смесь до получения влажного остатка. Прибавляют 5 капель раствора молибдата аммония, смесь перемешивают и переносят в центрифужную пробирку. После центрифугирования получают желтый кристаллический осадок. Второй вариант. В пробирку вносят 2—3 капли раствора арсената натрия, прибавляют 10—15 капель раствора молибденового реагента (раствор (NH4)2Mo04 и NH4N03 в HN03) и нагревают смесь несколько минут на водяной бане до выпадения желтого кристаллического осадка. Реакция с иодидами. Арсенат-ион при взаимодействии в кислой среде с иодид-ионами Г восстанавливается до арсенит-иона As033- с выделением иода, окрашивающего раствор в желтый цвет:
As043- +2I- + 2H+ ↔ As033- + I2+H20 В присутствии крахмала раствор окрашивается в синий цвет. Поскольку реакция обратима, то для смещения равновесия вправо ее проводят при избытке ионов водорода — в среде концентрированной НС1. Мешают окислители (например, N02-, NO3-, Br03- и др.). Методика. В пробирку вносят 3—5 капель раствора арсената натрия Na2HAs04, прибавляют 1—2 капли концентрированной НС1, 3—4 капли раствора иодида калия KI и 2—3 капли раствора крахмала. Раствор окрашивается в синий цвет. Другие реакции арсенат-ионов. Арсенаты восстанавливаются хлоридом олова(II) в растворе НС1 до свободного мышьяка As, выпадающего в виде черного осадка. При незначительном содержании арсенат-ионов в растворе их открывают, как и арсенит-ионы, реакцией восстановления до арсина AsH3 (см. выше «Реакция восстановления соединений мышьяка до арсина AsH3»). При внесении соединений мышьяка(III) или мышьяка(V) в пламя газовой горелки оно окрашивается в голубой цвет.
Аналитические реакции фторид-иона F-. Фторид-ион F- - анион одноосновной фтороводородной (фтористофодородной) кислоты HF средней силы (рК= 3,21). Водные растворы HF называют плавиковой кислотой. HF взаимодействует с обычным силикатным стеклом, образуя растворимые в воде продукты, поэтому растворы HF нельзя хранить в стеклянной посуде. |
||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 344. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 Ва + SO42-= BaS04 +
Ва + SO42-= BaS04 + 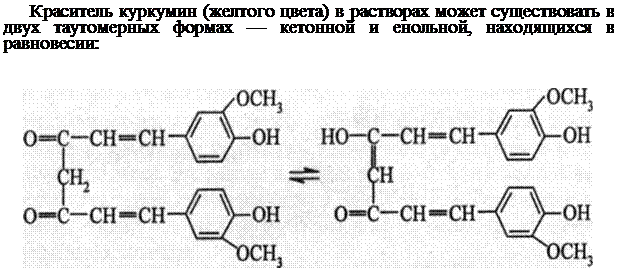 Реакцию образования куркуминового комплекса с борной кислотой можно предположительно описать следующим образом.
Реакцию образования куркуминового комплекса с борной кислотой можно предположительно описать следующим образом.