Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Саркома плечевой кости, конформное облучение. Трехмерная визуализация дозного распределенияСтр 1 из 5Следующая ⇒ Государственное бюджетное образовательное учреждение высшего Профессионального образования Минздравсоцразвития России «СЕВЕРО-ОСЕТИНСКАЯ ГОСУДАРТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Кафедра общей хирургии с курсом лучевой диагностики с лучевой терапией
Тема: « Технологические основы лучевой терапии. Лучевая терапия злокачественных опухолей. Реакция организма на лучевое лечение».
г. Владикавказ, 2012 г. зав.курсом лучевой диагностики и лучевой терапии, зав.кафедрой общей хирургии с курсом лучевой диагностики и лучевой терапии доцент Беслекоев У.С. . ассистент курса лучевой диагностики и лучевой терапии доцент Кораева И.Х к.м.н. Ганношенко Е.М. Алиева Е.А. Кубанцева И.Э., Созаонти З.Р.
Тема: « Технологические основы лучевой терапии. Лучевая терапия злокачественных опухолей. Реакция организма на лучевое лечение».
Цель занятия : Иметь представление о специализированном радиологическом отделении, устройстве радиационной техники, особенностях предлучевого периода. Радиационный контроль. 
Конкретные цели занятия:
Знать:
Уметь:
( рентгентерапия, теле-гамматерапия)
База проведения и материальное обеспечение занятия:
Содержание самостоятельной работы:
Литература: 1. » Кишковский А.Н,Дударев А.Л.»Лучевая терапия неопухолевых заболеваний».М,1977г. 2. Зетгенидзе Г.А. «Клиническая рентгенорадиология». М.1985г. 3. Линденбратен Л.Д., Королюк И.П., «Медицинская радиология и рентгенология», М. «Медицина», 2000г. 4.Г.Е.Труфанов «Лучевая диагностика и лучевая терапия», СПб, 2005. 5. «Лучевая диагностика».Учебник для вузов.Под ред.проф.Труфанова Г.Е. М,2007г.
Блок информации:
Лучевая терапия – один из основных, а нередко единственный метод лечения больных злокачественными заболеваниями. Для повышения эффективности лучевой терапии необходима топометрическая подготовка больных к облучению. Эффективность лучевой терапии зависит не только от радиопоражаемости опухоли, но и от соотношения доз ионизирующего излучения, получаемых опухолью и окружающими, особенно критическими к ионизирующему излучению здоровыми органами и тканями. Первым принципом клинической топометрии является строго индивидуальная подготовка. Вторым принципом является строгое соблюдение правила – исследовать больного в положении тела, идентично положению при планируемом облучении. Третий принцип клинической топометрии заключается в максимальном приближении физиологического состояния больного во время исследования к состоянию во время облучения. Так из всей массы средств и способов должны выбираться не обременительные для больного и не тяжелые для обслуживающего персонала, а наиболее необходимые и дающие достаточную информации. Свыше 75 лет рентгенотерапия находила широкое применение в онкологической, гинекологической, терапевтической, хирургической практике как один из активных биологических факторов. Этот метод является одним из наиболее распространенных методов лучевой терапии, который используется как в крупных лечебных учреждениях, так и в районных больницах для лечения не только опухолей, но и различных воспалительных процессов. Чаще всего используются отечественные устройства. Генерирование рентгеновских лучей производится при различных технических условиях. В рентгеновской трубке аппаратов генерируются неодинаковые по своей проникающей способности лучи, поэтому при лучевом лечении для получения однородности пучка используются фильтры. Так для близкофокусной терапии применяются алюминиевые фильтры, а при глубокой рентгенотерапии – медные и алюминиевые. Близкофокусная рентгенотерапия, при которой максимум поглощенной дозы достигается по существу в коже, может быть использована для лечения небольших опухолей кожи губ, слизистой рта, наружных половых органов, эпителиальных новообразований кожи. Близкофокусная рентгенотерапия может применяться в амбулаторных условиях и стационарных как самостоятельный метод или в комбинации с другими видами лучевой терапии, в частности с дистанционной гамма терапией или глубокой рентгенотерапией. Во всех случаях злокачественных опухолевых заболеваний близкофокусная рентгенотерапия проводится в виде курса лечения, который состоит из ежедневных сеансов однократного облучения в дозах от 100 до 500 r. Применение больших доз однократного облучения является положительной особенностью близкофокусной рентгенотерапии и разрешается только ввиду того, что действие излучения распространяется исключительно на опухолевые ткани. Длиннофокусная рентгенотерапия – лучевое лечение рентгеновыми лучами, генерированными при напряжении 180-250 Вольт. Применяются фильтры из материалов с большим удельным весом (не только алюминиевые, но и медные фильтры). Кроме того, используются большие расстояния, источник – кожа (30-60 см). При таких условиях достигается большая однородность излучений рабочего пучка. Гамма рентгенотерапия проводится в виде курса самостоятельного лечения, состоящего из 3-4 (при лечении воспалительных заболеваний) или 20-30 (при лечении опухолей) ежедневных процедур в виде комбинированного лечения с предшествующим или последующим оперативным удалением опухоли, а также в виде сочетанного лечения, например с близкофокусной рентгенотерапией, с аппликационной гамма терапией, и др. В процессе дистанционной рентгенотерапии при злокачественных опухолях однократная разовая доза составляет 200-250 r на каждое поле. Чаще облучение проводится с нескольких полей, и каждое облучается через день. При таком ритме облучения эритема на коже развивается через 12-15 дней, т.е. после достижения суммарной поверхностной дозы 1200-1400 r на поле. При суммарной дозе около 3000 r на коже появляются мелкие пузырьки, которые сливаются друг с другом, вскрываются, и образуется мокнущая поверхность. Поэтому облучение кожи в дозе более 3000 рад не допускается из-за возможных тяжелых лучевых повреждений. Однако, при лечении глубоко расположенных опухолей для создания необходимой очаговой дозы на опухоль, требуется облучение в дозе большей 3000 рад. С этой целью в практику дистанционной гамма терапии были введены специальные устройства – растры или свинцовые решетки. Свинцовые решетки вводят в обычные тубусы, при этом облучение производится не одним рабочим пучком площадью сечения равной размерам поля облучения, а несколькими потоками излучений с небольшой площадью поперечного сечения.
По своему назначению дистанционная гамма терапия соответствует длиннофокусной рентгенотерапии, однако по сравнению с последней имеет ряд преимуществ: 1.В гамма установках используются источники излучения с длительным периодом полураспада, так что активность препарата, а, следовательно, и интенсивность излучения весьма незначительно изменяются изо дня в день. В связи с этим мощность дозы гамма установок более стабильная, чем у рентгенотерапевтических аппаратов, а погрешность при дозировании в процессе дистанционной гамма терапии меньше, чем при рентгенотерапии. 2.Гамма излучение соотносительно меньше поглощается в коже, чем рентгеновские лучи, а потому допустимая величина экспозиционной дозы излучения кожи больше и составляет 4000 r. 3.Излучение дистанционных гамма установок характеризуется значительно меньшим спадом дозы на глубине по сравнению с рентгеновыми лучами, следовательно, больше будет относительная глубинная доза, что очень важно при лечении глубоко расположенных злокачественных опухолей. 4.Поглащение гамма лучей в мягких тканях и в костях более или менее равномерное, чем при обычной рентгенотерапии, что весьма важно для уменьшения лучевой нагрузки на кости, а в частности при облучении опухолей головы. Особенности распределения дозы излучения гамма установок дают возможность применять дистанционную гамма терапию практически при всех локализациях злокачественных опухолей и даже в тех случаях, когда обычная рентгенотерапия оказывается неэффективной. Для разрушения метастатических опухолей требуется провести их облучение только за счет дистанционной терапии в дозе около 5000 рад. Такое массивное облучение рентгеновскими лучами кожи привело бы к некрозу ее, тогда как гамма терапия проводится без развития тяжелых лучевых поражений. Дистанционная гамма терапия проводится также как и рентгенотерапия в виде курса лечения продолжительностью 1-2 месяца, с1-го или 2-х или более полей в дозах 200-300 рад на каждое. Облучение проводят по специальным схемам, используемым и при глубокой рентгенотерапии.
Установки для проведения гамма терапии. Методы статической дистационной терапии. В последнее время для дистанционной лучевой терапии стали применять бетатроны, в которых электронный пучок испытывает торможение не сразу, как в обычных рентгеновских трубках, а после предварительного ускорения электронов в вакуумной камере при воздействии мощных электромагнитов. В процессе ускорения электроны приобретают колоссальную энергию, которая достигает в медицинских бетатронах до 30 Меv и более. Крутой спад мощности дозы на определенной глубине позволяет считать, что использование пучка бетатрона является наиболее эффективным методом дистанционной терапии опухолей поверхностной локализации. Дистанционная гамма терапия может осуществляться и применением подвижных источников излучения, путем ротационного маятникового, конвергентно, и ротационного облучения с управляемой скоростью. Основным преимуществом подвижных методов является концентрация энергии излучения в области опухоли с одновременным крутым спадом дозы в окружающих здоровых тканях и значительное снижение лучевой нагрузки на коже. Однако, клиническое применение подвижного облучения лимитируется не реакцией кожи, а возможными лучевыми изменениями отдельных внутренних органов и системы крови, так как облучается больший объем тканей. Облучение может проводиться на отечественной установке «РОКУС», «АГАТ-Р».
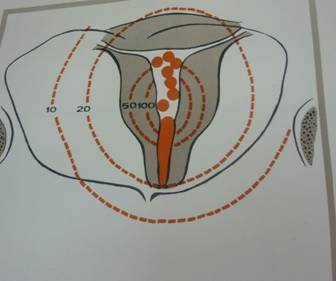
Устройство этого аппарата позволяет использовать углы вращения от 0 до 3600. В случаях, когда источник излучения во время лечения находится в непосредственной близости от опухоли или в ее ткани, облучение называется контактным. К контактным методам лучевой терапии относятся: внутриполостная, внутритканевая, радиохирургическая, аппликационная, избирательного накопления изотопов в тканях и близкофокусная рентгенотерапия. Как известно, применение метода определяется его дозиметрической характеристикой. Контактные методы лучевой терапии характеризуются резким падением величины дозы на ближайших от источника расстояниях. Отсюда, контактное облучение в самостоятельном виде может применяться лишь при небольших опухолях, не превышающих 1,5-2 см в диаметре. В остальных случаях контактные методы сочетаются с одним из способов дистанционной терапии. При злокачественных новообразованиях пищевода, мочевого пузыря, шейки матки, прямой кишки и других полостных органов радиоактивные препараты можно подводить непосредственно к опухоли. Такой способ облучения называется внутриполостным. При внутриполостной гамма терапии используется Ra226, Co60, цезий в виде линейных и объемных источников излучения. Линейный источник может быть изготовлен из цилиндрических препаратов Ra, Co, или шаровидных источников бус из Co и Cs. Препараты или бусы располагаются в одну линию в твердом резиновом зонде. С целью уменьшения мощности дозы на слизистой оболочке источник излучения должен отстоять от нее на 0,5-2 см. Для этого с наружной стороны зонда на уровне препаратов имеется тонкий резиновый баллон, в который после введения зонда нагнетается воздух создающий расстояние источник-опухоль. Общая активность источника излучения составляет 50-60 мкюри. Активная длина источника устанавливается в зависимости от размеров опухоли и должна превышать ее на 2 см с верхнего и нижнего краев. Линейный источник излучения применяется при внутриполостной гамма терапии рак пищевода, прямой кишки, шейки матки.
Аппликаторы для внутриполостного облучения
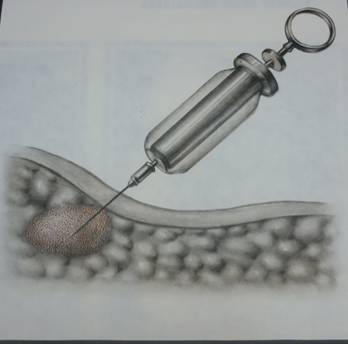
При внутриполостной β-терапии применяются коллоидные растворы Au198 и J90. К сожалению, малая проникающая способность β - частиц ограничивает показание к применению этих изотопов. Коллоидные растворы могут вводиться в мочевой пузырь, в брюшную полость и плевральную полость. Для внутриполостной β -терапии применяется раствор Au с величиной частиц от 20 до 200 мкюри и содержанием золота около 0,01г на 1 см3. При соблюдении мер защиты раствор вводится через катетер в мочевой пузырь и через 3,5-4 часа катетером удаляется. В брюшную полость раствор рад. Au вводится с профилактической целью для воздействия на возможную диссеминацию после резекции желудка или гастрэктомии по поводу рака, после резекции по поводу рака тонкой и толстой кишок, после операции по поводу рака яичников. Кроме того, раствор Au198 применяется при канкрозных асцитах с паллиативной целью. Противопоказаниями к введению радиоактивного раствора в брюшную полость являются стойкая лейкопения и тромбоцитопения, тяжелое общее состояние, наличие послеоперационных осложнений. Короткий период полураспада (2,7 дня или 65 часов) позволяет без риска побочного лучевого воздействия создать в очаге поражения источник излучения необходимой интенсивности.
Внутриполостная лучевая терапия.
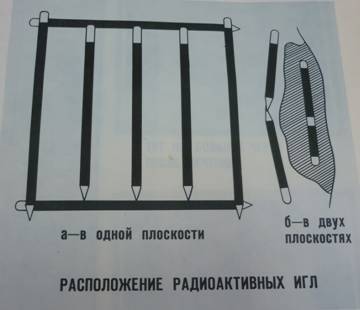
Способ лучевой терапии, при котором радиоактивное вещество во время лечения находится внутри ткани опухоли называется внутритканевым. В зависимости от используемого излучения различают гамма терапию и β-терапию. Внутритканевая гамма терапия показана при хорошо ограниченных небольших опухолях, объем которых можно определить довольно точно. Особенно целесообразно применение внутритканевого лечения при опухолях подвижных органов (рак нижней губы, языка, молочной железы, наружных половых органов) или при опухолях, требующих локального облучения (рак внутреннего угла глаза, века). Для проведения внутритканевой гамма терапии используются радиоактивные гамма излучающие препараты Ra, Co, Cs в форме игл, отрезков проволоки, цилиндриков или гранул. Иглы имеют оболочку из нержавеющей стали, которая служит фильтром, наружный диаметр иглы 1,8 мм. Внедрение радиоактивных игл в ткань опухоли производится в операционной с обязательным соблюдением правил асептики и антисептики, а так же защиты персонала от излучения. Обязательна местная анестезия тканей вокруг опухоли, в ткань опухоли новокаин не вводится. Внедрение иглы вводится специальным инструментарием, погружается по ушко, а нитью, введенной в ушко, фиксируется к коже. В течение всего времени внутритканевого облучения больной находится в специальной активной палате. По достижении необходимой очаговой дозы радиоактивные иглы извлекаются потягиванием за нити.
Внутритканевая гамма терапия иглами не лишена недостатков. Кроме травматичности этой процедуры в тканях вокруг иглы за счет высокой дозы возникает некротический канал, вследствие чего источник излучения может смещаться и даже выпадать. Совершенствование и поиски новых форм препаратов привели к использованию при внутритканевой гамма терапии гранул из радиоактивного кобальта в нейлоновых трубочках. Нейлоновые трубочки имеют меньший наружный диаметр, минимально травмируют окружающие ткани и значительно сокращают время контакта персонала с радиоактивным веществом. Благодаря гибкости и эластичности источнику излучения можно придать форму, приближающуюся к конфигурации опухоли. При внутритканевой гамма терапии оптимальной дозой во времени, т.е. мощностью дозы является 35-40 рад/час. Такая мощность дозы позволяет за 6-7 дней подвести к опухоли 6000-6500 рад. и вызвать радикальное повреждение опухоли.
Разновидностью внутритканевого облучения является радиохирургический метод. Сущность метода заключается в образовании доступа к опухоли и воздействии на нее радиоактивными препаратами или в облучении радиоактивными веществами ложа опухоли после ее удаления. Радиохирургический метод можно применять при различных локализациях опухолевого процесса I и II стадии, а также при опухолях, находящихся на границе неоперабельности, но без наличия отдаленных метастазов. Этот метод показан при метастазах рака полости рта, губы, гортани, в подчелюстные и шейные лимфатические узлы, при саркомах мягких тканей, раке наружных половых органов. При радиохирургическом методе лечения применяются как гамма, так и β - излучатели. Форма радиоактивного препарата может быть самой разнообразной. Применяются иглы, нейлоновые трубочки с гранулами кобальта, гранулы Au, танталовая проволока, коллоидные радиоактивные растворы, а также рассасывающие нити импренированные ими. Метод введения коллоидного раствора Au 198 при внутрикожных метастазах
При лечении некоторых воспалительных процессов и злокачественных новообразований кожи и слизистой оболочки радиоактивные препараты можно расположить либо непосредственно на поверхности патологического очага, либо отдалив их на расстояние не более 0,5-1,5 см. Такой способ облучения называется аппликационным. В зависимости от размеров и глубины поражения используется гамма излучающие радиоактивные препараты. Аппликационная β-терапия применяется при лечении процессов, распространяющихся в поверхностных слоях (до 4 мм) кожи и слизистой оболочки (капиллярные ангиомы, гиперкератозы, лейкоплакии, нейродермиты, эрозии). β-излучение P, интрия, талия, прометия, стронция, ксенона действуют на патологический очаг, не облучая подлежащие ткани. Пластины различных размеров с радиоактивным веществом толщиной от 0,1 мм до 0,35 мм покрываются тонкой полиэтиленовой или теримновой пленкой. Лечение больных с капиллярными ангиомами проводится в виде курса, состоящего из 6-9 ежедневных сеансов облучения. Ежедневная доза составляет 300-500 рад, а суммарная за весь курс 2000-3000 рад. Результаты лечения у детей обычно лучше, чем у взрослых. При экземе аппликационная β-терапия применяется лишь тогда, когда другие методы эффекта не дают. В результате лечения обычно уменьшается воспалительный процесс, инфильтрация кожи, ослабевает и исчезает зуд. Аппликационная гамма терапия применяется в тех случаях, когда процесс располагается на глубине более 4 мм и показана при опухолях кожи и слизистой оболочки, рецидивах и метастазах в коже и подкожной клетчатке. При аппликационной гамма терапии радиоактивные препараты помещают в специальные маски-муляжи, моделирующие форму облучаемой поверхности. Муляж изготавливается из смеси воска и парафина. Пластина из этой массы толщиной в 0,5-1,0 см разогревается в горячей воде (до 400) и когда становится мягкой, накладывается на поверхность, подлежащую облучению. Чтобы поверхность излучения точно соответствовала патологическому очагу, ее очерчивают фуксином, после чего на муляже остается отпечаток контуров области, подлежащей облучению. Внутри этого контура укладываются радиоактивные препараты. Для получения равномерного дозного поля необходимо соблюдать определенные правила расположения препаратов. Чаще располагают препараты в виде прямоугольника или круга, но обязательно таким образом, чтобы площадь облучения превышала видимые размеры патологического очага. Аппликационная гамма терапия может проводиться путем непрерывного или фракционного облучения.
Наконец, необходимо отметить еще один метод лучевой терапии, основанный на избирательном поглощении тканями или органами тех или иных радиоактивных препаратов, получившего название внутреннего облучения. Радиоактивные препараты вводятся per.os, в/в, внутриартериально.
Метод внутреннего облучения
В настоящее время для внутриартериальной терапии применяются коллоидные растворы P, J, Au. Радиоактивный Au198 применяется при лечении лейкозов. Коллоидный раствор вводится внутривенно из расчета 0,5-1 мкюри на 1 кг веса больного, при суммарной дозе 5 мкюри. При необходимости повторный курс проводится через 4-6 месяцев, причем вводится 1/2 или 1/3 первоначальной дозы. Радиоактивный J131 применяется в основном при гипертиреозах II и III стадии, рецидивах опухоли после операции, при раке щитовидной железы как самостоятельный метод лечения, а также с профилактической целью в качестве пред- и послеоперационного лечения. Внутреннее облучение рад. J ограничивается воздействием ионизирующего излучения на гиперплазированные клетки щитовидной железы, не повреждая окружающие органы и ткани. При лечении тиреотоксикоза больной в течение 1,5-2 месяцев должен исключить из еды продукты, содержащие йод и не принимать йодистые препараты. Доза радиоактивных препаратов зависит от степени гиперфункции щитовидной железы. Необходимое для лечения количество J можно применить одномоментно или дробно 1,5-2 мкюри. При раке щитовидной железы с целью уменьшения митотической активности клеток за 2-3 недели до операции назначается 30-45 мкюри. После радикальной операции в ранних стадиях назначается J131 по 5 мкюри каждые три недели до суммарной дозы 50-100 мкюри. При неоперабельном раке щитовидной железы вводится J по 50-60 мкюри каждые 2-3 недели до получения терапевтического эффекта. Каждый из рассмотренных методов лучевой терапии имеет свои достоинства и недостатки. Так дистанционное облучение не обеспечивает в полной мере соотношение в поглощенных дозах. Даже, казалось бы, при благоприятных условиях облучается большой объем здоровых тканей, регенераторная способность которых значительно уменьшается. Контактные методы облучения создают более благоприятное соотношение в дозах. Однако, при опухолях, распространяющихся на большую глубину, чем 1 см, применение контактных методов будет неэффективным. Поэтому, для более рационального облучения необходимо сочетать дистанционное облучение с одним из контактных методов. Такой способ лечения получил название сочетанного метода лучевой терапии.
В плане комбинированного лечения лучевая терапия может сочетаться с хирургическим вмешательством, химиотерапией или одновременно тем и другим. Последовательность ее применения зависит от стадии заболевания, клинической формы опухоли, ее локализации и общего состояния больного. Лучевая терапия может осуществляться в различных вариантах дистанционного, внутриполостного, внутритканевого облучения с электрокоагуляцией, резекцией или экстирпацией пораженного органа.
Отсюда различают следующие методы лучевой терапии:
· Самостоятельная лучевая терапия – лучевая, или химиотерапия; · Сочетанная лучевая терапия – дистанционное облучение с облучение одним из контактных методов; · Комбинированная лучевая терапия- лучевая терапия с хирургическим методом; · Комплексная лучевая терапия- лучевая и химиотерапия.
Планирование лучевой терапии n Результаты научных исследований позволяют планировать дозы и число фракций, при которых не будет превышен уровень толерантности нормальных тканей; n Применять различные режимы фракционирования; n Усиливать действие ионизирующего излучения на опухоль; n Защищать окружающие ткани
При опросе выясняют, не проводилось ли больному в прошлом лучевое лечение. Если оно имело место, то следует узнать все подробности (когда и по какой методике выполняли лучевую терапию, какие отделы организма облучали, в какой суммарной дозе, какие осложнения наблюдались). Нельзя полагаться только на сообщение больного — нужна выписка из истории болезни или письменная справка из медицинского учреждения, в котором он проходил лечение. Это крайне важно, потому что при лечении опухолей повторный курс облучения можно проводить только через 60—70 дней после окончания первого и с учетом условий предыдущего облучения. Впрочем, выше уже отмечалось, что эффективность повторных курсов низка. Первый курс должен быть максимально радикальным и по возможности единственным
На основании результатов всестороннего обследования больного онколог, лучевой терапевт ( а нередко терапевт и гематолог ) вырабатывают согласованную стратегию лечения. Она зависит от локализации опухоли, ее размеров, гистологической природы и стадии развития. Опухоль небольшого размера может быть излечена с помощью как оперативного вмешательства, так и лучевой терапии. В этом случае выбор метода зависит прежде всего от локализации новообразования и возможных косметических последствий вмешательства К тому же нужно учитывать, что опухоли, исходящие из разных анатомических областей, различаются по своим биологическим характеристикам. К числу опухолей, поддающихся радикальному лечению (радиокурабельные опухоли ) относят рак кожи, губы, носоглотки, гортани, молочной железы, а также ретинобластомы медуллобластомы, семиномы, дисгерминомы яичника, локализованные лимфомы и лимфогранулематоз.
Лучевое уничтожение большой опухоли наталкивается на почти непреодолимые трудности ввиду лучевого повреждения ее сосудов и стромы с исходом в радиационный некроз. В таких случаях прибегают к комбинированному лечению. Комбинация лучевого воздействия и оперативного вмешательства дает хорошие результаты при опухоли Вилмса и нейробластомах у детей, раке сигмовидной и прямой кишки (так называемый колоректальный рак), эмбриональном раке яичка, рабдомиосаркомах, саркомах мягких тканей. Оперативное вмешательство очень важно для удаления остатка опухоли после лучевой терапии. В то же время лучевая терапия показана при рецидиве раковой опухоли после хирургического или комбинированного лечения (рецидив рака кожи, нижней губы, шейки матки), а также при локальных метастазах в лимфатических узлах, костях, легких.
Предлучевой период В предлучевом периоде проводят подготовку больного к лечению. Ее следует начинать с психологической подготовки. Пациенту разъясняют необходимость лучевого воздействия, его эффективность, указывают на возможные изменения самочувствия и некоторые лучевые реакции, особенности режима и питания. Беседа с больным должна вселить в него надежду и уверенность в хороших результатах лечения
Дальнейшими этапами подготовки являются усиленное питание с потреблением большого количества жидкости, насыщение организма витаминами (в частности, не менее I г витамина С в сутки), санация облучаемых поверхностей и полостей. n В местах, подлежащих облучению, кожа должна быть чистой, без ссадин и гнойничков. n Все физиотерапевтические процедуры и медикаментозные средства для наружного применения типа мазей, болтушек отменяют. n При облучении лицевого отдела головы проводят санацию полости рта. n Запрещают употребление спиртных напитков и курение. При сопутствующем воспалительном процессе назначают антибиотики, при анемии — средства для ее коррекции. Следующим ответственным этапом является клиническая тонометрия, описанная выше. Здесь же необходимо еще раз подчеркнуть, что в связи с появлением компьютерной и магнитно-резонансной томографии создаются принципиально новые возможности предельно точной наводки пучков излучения на мишень. От анализа расположения мишени на плоскости совершается переход к объемному восприятию опухоли, от анатомической информации — к геометрическим представлениям, к построению сложных дозиметрических распределений, обеспечиваемых компьютерными программами n На основании результатов клинико-радиобиологического анализа и топометрии подбирают такой вид излучения и такие физико-технические условия облучения, чтобы произошло поглощение намеченного количества энергии в опухоли при максимальном снижении дозы в окружающих тканях. Иными словами, устанавливают оптимальную суммарную поглощенную дозу излучения, разовую дозу (дозу от каждого облучения), общую длительность лечения.
С учетом топографоанатомических особенностей опухоли и ее гистологической структуры выбирают дистанционное контактное или сочетанное облучение. Определяют технологию облучения и вид устройства (аппарата), которое будет использовано. С лечащим врачом согласовывают условия проведения курса - амбулаторно или в стационаре. С инженером-физиком врач по дозиметрическому плану намечает оптимальное распределение полей для дистанционного облучения. Статическое облучение можно проводить через одно входное поле на поверхности тела (однопольное облучение)либо через несколько полей (многопольное облучение).Если поля расположены над облучаемой областью с разных сторон таким образом, чтобы опухоль оказалась в перекресте радиационных пучков, говорят о многопольном перекрестном облучении . Это наиболее распространенный способ. Он позволяет значительно увеличить очаговую дозу по сравнению с дозой в соседних органах и тканях. Основная задача клинической топометрии является определение объема облучения на основе точной информации о локализации, размерах патологического очага, а также об окружающих здоровых тканях и представление всех полученных данных в виде анатомо-топографической карты (срезы) . Карту выполняют в плоскости сечения тела пациента на уровне облучаемого объекта. На срезе отмечают направления источников излучения при дистанционной лучевой терапии или расположение источников излучения при контактной терапии. Выбор количества, локализации, формы и величины полей строго индивидуален. Он зависит от вида и энергии излучения, требуемых разовой и суммарной доз, размеров опухоли, величины зоны ее субклинического распространения. Наиболее часто используют два противолежащих поля, три поля (одно спереди или сзади и два сбоку), четыре поля с перекрещивающимися в очаге пучками. При подвижном облучении источник радиации перемещается относительно больного. Наиболее распространены три способа подвижного облучения: ротационное, секторное и касательное. При всех этих способах пучок излучения наведен на опухоль. Лучевую терапию проводят с двух встречных фигурных полей сложной конфигурации, при необходимости с подключением третьего дополнительного поля. В поле облучения включают опухоль, Mts в лимфоузлах ( бронхолегочных, корневых, верхних и нижних трахеальных, паратрахеальных) или зоны их локализации. n После достижения суммарной очаговой дозы 45-50 Гр рекомендуется уменьшить поля облучения и довести дозу облучения до 70-80 Гр Предлучевой период завершается окончательным оформлением лечебного плана. Лечебный план — это набор документов клинико-радиобиологического и клинико-дозиметрического планирования, включающий как карту дозного распределения в теле пациента, так и рентгенограммы, сделанные через входные поля и подтверждающие правильность наводки пучков излуче ния на очаг. n К началу лучевого периода необходимо произвести разметку полей облучения на теле больного. Для этого пациенту придают то положение, которое он будет занимать во время лечебных облучений. Далее осуществляют наводку пучка излучения на опухоль (конечно, установка при этом не включена и облучение не проводят). Во время укладки пациента на столе радиотерапевтического аппарата – лазерные центраторы или световые поля источников излучения совмещают с метками на поверхности тела. n Центральная ось пучка должна проходить через центр входного поля и центр опухоли, поэтому наводку на очаг при статическом облучении называют центрацией.
В случае ротации облучение проводят по всему периметру тела больного. Достоинством метода является концентрация поглощенной дозы в очаге поражения с одновременным уменьшением дозы в окружающих тканях, особенно в коже. Однако интегральная поглощенная доза в организме пациента оказывается значительной. Условно можно считать, что ротационный метод является предельным вариантом многопольного перекрестного облучения, когда количество полей крайне велико. Метод показан при локализации опухоли вблизи срединной оси тела (например, при раке пищевода). При секторном облучении источник перемещается относительно тела больного по дугев пределах выбранного угла —90°, 120°, 180° (рис. IV.8). Такойметод целесообразно применять при эксцентрическом расположении опухоли в теле больного (например, при раке легкого или мочевого пузыря). При касательном облучении центр вращения системы находится на небольшой глубине под поверхностью тела. Тем самым пучок из перемещающегося источника все время направляется по касательной относительно облучаемого отдела тела пациента. Это выгодно при облучении поверхностно расположенного очага достаточной протяженности (например, при диссеминации раковых узелков в коже грудной стенки после удаления молочной железы).
Центрацию можно осуществлять с помощью механических средств: тубуса-локализатора, стрелок-указателей или стержней, соединенных с радиационной головкой. Более удобны оптические методы центрации: световой пучок отбрасывается зеркалом в направлении пучка ионизирующего излучения и освещает поле на поверхности тела больного. Это световое поле совмещают с размеченным на коже запланированным полем и световыми «зайчиками»,направленными перпендикулярно к нему от дополнительных центраторов. В последние годы созданы специальные аппараты – симуляторы,которыепризваны имитировать все движения источника излучения. Симулятор- это рентгеновская установка, снабженная усилителем рентгеновского изображения и дисплеем для демонстрации изображения. Трубка может перемещаться по окружности вокруг больного.
Лучевой период — период проведения облучений при постоянном врачебном наблюдении за больным. Клиническое курирование пациента влучевом и послелучевом периодах крайне важно, т.к. позволяет видоизменять лечебный план и определять необходимое сопутствующее лечения. n Для облучения каждого поля больному придают удобное положение. Исключительно важна иммобилизация пациента. n Даже небольшое перемещение его ведет к изменению дозного распределения. Иммобилизацию осуществляют посредством разных приспособлений. n Для фиксации головы и шеи применяют фиксирующие приспособления, изготовленные из термопластического материала. Его размягчают в горячей воде, а затем моделируют для соответствующего больного, после чего материал быстро затвердевает. n Правильность наводки пучка проверяют с помощью симулятора или рентгенографии (в последнем случае на края намеченного поля помещают рентгеноконтрастные тонкие катетеры или свинцовые метки, чтобы получить их изображение на снимках). n В процессе облучения врач или лаборант наблюдают за больным на экране телевизора. n Переговорное устройство обеспечивает двустороннюю связь врача и больного. По окончании облучения больному предписывают отдых в течение 2 ч на свежем воздухе или в палате с хорошей вентиляцией. n Информацию о каждом облучении записывают в историю болезни.
Стандартные карты изодозпоказывают распределение поглощенной энергии в тканях при условии, что пучок излучения падает на облучаемую поверхность перпендикулярно к ней. Однако реальная поверхность тела человека на большинстве участков округло-выпуклая. Для того, чтобы избежать искажения расчетного распределения дозы, используют компенсаторы, или болюсы, изготовленные из тканеэквивалентного материала (например парафина).
n Фильтр в форме клина позволяет изменять дозное распределение в тканях, так как под узкой частью клина поглощенная доза заметно выше, чем под расширенной.
n При распространенных опухолях иногда проводят неравномерное облучение с помощью решетчатых фильтров. Такой фильтр представляет собой свинцовую пластину с многочисленными отверстиями. Излучение попадает только на те участки поверхности тела, которые находятся под отверстиями. Под прикрытыми свинцом участками доза в 3—4 раза меньше и обусловлена только рассеянным излучением. n При облучении объектов неправильной формы возникает необходимость в применении полей облучения сложной конфигурации. n Такие ≪фигурные≫ поля можно получить с помощью свинцовых или вольфрамовых экранирующих блоков. Их размещают на специальных подставках, которые крепят к радиационной головке аппарата. С этой же целью используют фигурную экранирующую диафрагму, составленную из свинцовых блоков. n Этим путем удается защитить особенно чувствительные к облучению органы: глаза, спинной мозг, сердце, гонады и др., которые могут оказаться вблизи зоны облучения. n Иногда защитный свинцовый блок располагают в центральной части рабочего пучка. Он как бы расщепляет дозное поле на две половины. Это целесообразно, например, при облучении легких, когда нужно защищать от облучения спинной мозг и сердце. n Фракционированное облучение является основным методом подведения дозы при дистанционной терапии. Облучение проводят отдельными порциям, или фракциями.
Применяют различные схемы фракционирования дозы: ü обычное( классическое) мелкое фракционирование -- 1,8-2,0 Гр в зависимости от гистологического вида опухоли ü Среднее фракционирование – 4,0-5,0 Гр в день 3 раза в неделю; ü Крупное фракционирование -- 8,0-12,0 Гр в день 1-2 раза в неделю; ü Интенсивно-концентрированное облучение – 4,0-5,0 ежедневно в течении 5 дней, ( например в качестве предоперационной подготовки; ü Ускоренное фракционарование – облучение 2-3- раза в сутки обычными фракциями с уменьшением суммарной дозы за весь курс лечения; ü Гиперфракционирование , или мультифракционирование – дробление суточной дозы на 2-3- фракции с с уменьшением дозы за фракцию до 1,0-1,5 Гр с интервалом 4-6 часов, при этом продолжительность курса может не измениться, но доза повышается; ü Динамическое фракционирование – облучение с различными схемами фракционирования на отдельных этапах лечения; ü сплит-курсы – режим облучения с длительным перерывом на 2-4 недели в середине курса или после достижения определенной дозы; ü Низкодозный вариант фотонного тотального облучения тела – от 0,1-0,2 до 1-2 Гр суммарно; ü Высокодозный вариант фотонного тотального облучения тела от 1-2 до 5-6 Гр суммарно; ü Низкодозный вариант фотонного субтотального облучения тела – от 1-1,5 Гр до 5-6 Гр суммарно; ü Высокодозный вариант фотонного субтотального облучения тела от 1-3 до 18-20 Гр суммарно; ü Электронное тотальное или субтотальное облучение кожи в различных режимах при ее опухолевом поражении ü Величина дозы за фракцию имеет большее значение, чем общее время курса лечения. Крупные фракции более эффективны, чем мелкие. Укрупнение фракций при уменьшении их числа требует уменьшения суммарной дозы, если не изменяется общее время курса.
Таким образом, основная задача при проведении сеансов облучения – обеспечить точное воспроизведение на терапевтической установке запланированных условий облучения
Лучевая терапия: пред-, или послеперационное облучение, самостоятельное.
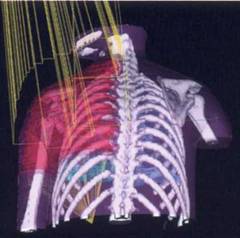
Показания к предоперационному облучению: ü размеры опухоли более 3 см в диаметре; ü метастазы; ü фиксация к коже, изъязвления кожи; ü быстрый рост опухоли Цель – уменьшить объем опухоли, перевести ее в операбельную форму, уничтожить пролиферирующие клетки опухоли, снизить вероятность диссеминации опухолевых клеток во время операции. Саркома плечевой кости, конформное облучение. Трехмерная визуализация дозного распределения
Современный принцип лечения: сочетание химиотерапии, облучения, операции. Предоперационная луч. терапия в суммарной очаговой дозе 45-50 Гр. Операцию проводят после стихания лучевой реакции.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 313. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |