
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамические потенциалы
3.1 Какое основное условие самопроизвольности процесса? 3.2 Что такое максимальная полезная работа? 3.3 Какие условия определяют возможность процесса при 3.4 Какое условие необходимо для системы, находящейся в равновесии? 3.5 Что такое характеристические функции? 3.6 Экстремальными или интенсивными параметрами являются термодинамические потенциалы? Докажите. 3.7 Как влияет повышение температуры на 3.8 Выведите уравнение, связывающие 3.9 При каких условиях 3.10 Для некоторых соединений 3.11 Всегда ли устойчивы при нормальных условиях соединения, для которых 3.12 Определите условия возможности протекания экзотермической и эндотермической реакций. 3.13 Разберите с точки зрения термодинамики процесс растворения соли в воде. 3.14 В каких случаях изменение энтальпии может служить критерием возможности процесса? 3.15 В каких случаях изменение энтропии определяет направление процесса? 3.16 Как изменяется влияние энтропийного фактора при повышении температуры? 3.17 Как можно рассчитать 3.18 При каких условиях 3.19 Что такое химический потенциал? 3.20 Определите понятия активность, фугитивность, коэффициент активности. 3.21 По термодинамическим характеристикам белого и серого олова определите, какая форма устойчива при нормальных условиях. При какой температуре эти формы находятся в равновесии? 3.22 Возможны ли при нормальных условиях реакции: а) б) Какие реакции связывания атмосферного азота могут самопроизвольно протекать при нормальных условиях?  3.23 Рассчитайте 3.24 Возможны ли при нормальных условиях процессы: а) б) в) г) 3.25 Возможно ли получение анилина по реакции
Химическое равновесие
4.1 Что такое химическое равновесие? Определите этот термин, исходя из термодинамических представлений и исходя о скоростях химических реакций в системе. 4.2 Что такое смещение химического равновесия? 4.3 Какая разница между истинным равновесием и “замороженным” состоянием? Как доказать истинность равновесия? 4.4 В чем заключается разница между 4.5 Напишите уравнения для а) б) в) Найти соотношения между 4.6 Сформулируйте принцип Ле-Шателье. 4.7 Как изменяется химическое равновесие в системе при повышении температуры. Покажите это на основе принципа Ле-Шателье и уравнения Вант-Гоффа. 4.8 Как зависит константа равновесия от температуры? Какой параметр процесса определяет смещение равновесия в системе с химической реакцией. 4.9 Как рассчитать 4.10 Если в трубку, содержащую смесь 4.11 При повышении температуры давление водяного пара над
4.13 В какую сторону сместится равновесие в системе 4.14 В какую сторону сместится равновесие в системе 4.15 Как влияет повышение температуры и давления на равновесие в следующих системах: а) б) в) как установить истинность равновесия в этих системах? 4.12 4.13 4.14 4.15 4.16 Предложите экспериментальные методы определения констант равновесия в системах: а) б) в) 4.17 В сосуде смешали 3 л. 4.18 В системе протекает реакция 4.19 При некоторой температуре в смеси 1 моля 4.20 Рассчитайте равновесные концентрации в системе 4.21 Как рассчитать давление пара P = const повысить температуру? Повысить давление при 4.22 Рассчитайте давление над
5. Гетерогенное равновесие в однокомпонентных системах 5.1 Что такое фаза? Компоненты? Минимальное число компонентов? 5.2 Сколько фаз может быть в однокомпонентной системе? В двухкомпонентной системе? 5.3 При каких условиях правило фаз Гиббса может быть описано формулами 5.4 Сколько фаз может быть в системе 5.5 Система представляет собой насыщенный раствор NaCl твердый NaCl, водяной пар. Сколько степеней свободы имеет эта система? Можно ли произвольно менять температуру в системе? Температуру и давление? 5.6 Жидкая вода находится в равновесии с водяным паром. Сколько степеней свободы в этой системе? Как связаны с ней между собой температура и давление? 5.7 Одним из методов анализа системы является исследование кривых охлаждения. Постройте кривую охлаждения для воды от -10℃ до +150℃ при P = 1 атм. как изменится кривая охлаждения, если процесс идет при P = 0,5 атм? P = 2 атм? 5.8 Почему температура тройной точки воды отличается от температуры плавления? Какую информацию о процессе плавления льда можно получить, исходя из температуры плавления и температуры тройной точки? 5.9 Почему ‘скрипит’ снег под ногами? Почему скрип прекращается, если температура воздуха близка к 0℃?
Растворы
6.1 Дайте определение разных способов выражения концентрации растворов: молярности, моляльности, мольной доли, весовой доли. 6.2 Выразите концентрации приведенных ниже водных растворов всеми способами, известными вам. В скобках приведена плотность растворов г/см ³ : а) 6М раствор HCl /1,10/ б) 2,2М раствор NaOH /1,25/ в) 90% раствор г) 47% раствор 6.3 Сколько грамм KOH необходимо для приготовления 3 л. 20% раствора /плотность раствора – 1,18 г/см ³/. Рассчитайте моляльность и молярность этого раствора и мольную долю воды в нем. 6.4 Как приготовить 100 г. раствора этилового спирта в бензоле, в котором мольная доля спирта составляет 0,1? 6.5 Смешано 300 г. 5% и 500 г. 10% растворов некоторого вещества. Определите концентрацию получившегося раствора. 6.6 Что такое идеальный раствор? Какие вещества могут образовывать растворы, близкие к идеальным? 6.7 Сформулируйте первый закон Рауля. Чем объясняются отклонения от него в реальных растворах? 6.8 Как рассчитать состав пара над идеальным раствором? Над реальным раствором? 6.9 Что такое ректификация? Нарисуйте схему ректификационной колонны. 6.10 Что такое азеотропная смесь? Как ее разделить? 6.11 Что такое абсолютный спирт? Как его получить? 6.12 Что такое парциальные мольные величины? Как их рассчитать? 6.13 Что такое коэффициент активности? 6.14 Что такое избыточные величины? 6.15 Под колпаком находится стакан с холодным сладким чаем и стакан с водой. Какой процесс пойдет? Когда он остановится? 6.16 Чистоту органических веществ нередко оценивают по температуре плавления и температуре кипения. Что вы думаете о правильности таких оценок? 6.17 Какой чай в стакане быстрей остынет, сладкий или не сладкий? 6.18 Всегда ли раствор замерзает при более низкой и кипит при более высокой температуре, чем чистый растворитель? 6.19 Что такое осмос? Осмотическое давление? Где встречается и используется явление осмоса дома? В биологических явлениях? 6.20 Какую информацию можно получить из криоскопических измерений? 6.21 Найти давление паров воды над раствором 30 г. сахара в 200 г. 6.22 Почему лед весной становится рыхлым? Почему замороженное мясо перед оттаиванием теряет твердость? 6.23 Водный раствор некоторого нелетучего вещества замерзает при -1℃. При какой температуре он будет кипеть? Какое давление пара будет над ним при 100℃? 6.24 Найти молекулярный вес растворенного вещества, если водный раствор 1 г. вещества в 50 мл. воды замерзает при температуре -0,015℃. 6.25 В виде каких частиц находится йод в растворе в нитробензоле, если раствор 0,1482 г. йода в 22,4051 г. нитробензола замерзает при 5,39℃. Чистый нитробензол замерзает при 5,82℃. Криоскопическая константа нитробензола – 8,1 К/л.моль. 6.26 Для раствора 0,8 г. белка в 150 мл. воды в осмометре обнаружено при 25℃ повышение уровня раствора на 248 мм. Вычислите молекулярный вес белка. При какой температуре этот раствор будет замерзать? Кипеть? 6.27 Рассчитайте 6.28 Что такое изотонический коэффициент? В каких пределах может меняться изотонический коэффициент в растворе 6.29 Что такое кажущаяся степень диссоциации сильного электролита в растворе? 6.30 Имеются растворы уксусной кислоты и ацетата натрия одинаковой концентрации. Какой раствор замерзнет при более низкой температуре? Какой раствор закипит при более высокой температуре? 6.31 Раствор тростникового сахара концентрацией 0,8718 М при Т=291°К изоосмотичен с раствором 6.32 Какое давление пара при 25℃ будет над водным раствором, содержащим 3 г. NaCl в 100 мл. раствора? Плотность раствора – 1 г/см³, степень диссоциации NaCl принять равной 1, давление пара над водой при 25℃ 31,68∙10² Па. 6.33 Раствор 6.34 Что такое pH? Как изменяется pH чистой воды при повышении температуры? 6.35 Чему равен pH раствора HCl концентрацией 6.36 Чему равен pH раствора KOH концентрацией 6.37 Рассчитайте pH и степень диссоциации в растворе азотистой кислоты концентрацией 6.38 К какой величине стремится степень диссоциации HCN при бесконечном разбавлении? 6.39 Предложите несколько способов оценки степени диссоциации слабого электролита. 6.40 pH раствора одноосновной кислоты концентрацией 6.41 Рассчитайте pH и степень диссоциации слабого электролита, в растворе 1 л. которого содержит: а) 0,01 М б) 0,1 М в) г) 0,02 М д) 0,05 М Степень диссоциации слабого электролита считать равной 1. 6.42 Если разбавлять морс, приготовленный из ягодного сока с сахаром, то он становится более кислым /убедитесь практически, что это так/. Как можно объяснить это явление? 6.43 Как изменится pH раствора 0,01 М раствора HCl при введении в раствор KCl? 6.44 Сколько граммов 6.45 Растворимость 6.46 Найти концентрацию ионов 6.47 Выпадет ли осадок 6.48 Как изменится концентрация насыщенного раствора
Электрохимия
7.1 Что называется удельной электропроводностью раствора? Мольной электропроводностью? 7.2 Как изменяются удельная и мольная электропроводности с изменением концентрации раствора? 7.3 Как измеряют электропроводность раствора? Что такое ”постоянная ячейки” ? 7.4 Как рассчитать степень диссоциации электролита в растворе по значению электропроводности раствора? 7.5 Что такое ионные проводимости в растворах? Закон Кольрауша. 7.6 Объясните, почему ион лития в водном растворе наименее подвижен по сравнению с другими ионами щелочных металлов, хотя он имеет наименьший диаметр? 7.7 Что такое эстафетная проводимость? 7.8 Чем определяется заряд металлической пластинки в растворе соли данного металла? Как изменить этот потенциал? 7.9 Что такое стандартный электродный потенциал? 7.10 Как рассчитать электродный потенциал при температуре, отличающейся от 298°К? 7.11 Объясните, почему железо растворяется в разбавленной серной кислоте, а медь не растворяется? 7.12 Серебро не растворяется в разбавленной серной кислоте, но растворяется в разбавленных азотной и йодистоводородной кислотах. Объясните это. 7.13 При какой концентрации ионов железа /+2/ в растворе потенциал железной пластинки,опущенной в этот раствор, будет равным 0? 7.14 Что такое стеклянный электрод? Дня чего он применяется? 7.15 Что такое хлорсеребряный электрод? Как рассчитывают его потенциал? 7.16 Как устроен каломельный электрод? От чего зависит его потенциал? 7.17 Что такое водородный электрод? 7.18 Что такое мембранный потенциал? Какое значение он имеетв биологии? 7.19 Определите направление процессов в таких системах /A=1/: а) б) в) г) 7.20 Сконструируйте элементы,в которых реализуется следующие процессы: а) б) в) г) д) е) ж) 7.21 Что такое концентрационный элемент? Рассмотрите термодинамику его работы. 7.22 По значениям стандартных потенциалов рассчитайте константу равновесия дляреакции
7.23 Могут ли идти реакции дисмутации: а) б)
7.24 Рассчитайте ЭДС элемента:
Цифры под символами ионов означают активность соответствующих ионов. 7.25 Вычислите ЭДС гальванического элемента:
0,5 М 0,05 М Цифры под символами веществ означают молярные концентрации веществ в растворе. Эквивалентная электропроводность 0,05 М раствора составляет 99,5
Химическая кинетика
8.1 Что такое порядок химической реакции? Какие вы знаете способы определения? 8.2 Как найти константу скорости химической реакции? 8.3 Почему порядок химической реакции отличается от стехиометрических коэффициентов в уравнении реакции? 8.4 Что такое последовательные реакции? Как оценить скорость реакции, которая проходит в несколько этапов? 8.5 Что такое цепные реакции? 8.6 В некоторых случаях скорость реакции зависит от объема реакционной смеси. Как это можно объяснить? 8.7 Для реакции 8.8 Как изменится скорость реакции
8.9 Период полураспада трития - около 12 лет. Рассчитайте время, необходимое для распада 90% трития, 99% трития. Сколько трития распадется через 120 лет? 8.10 Растворение 8.11 Уравнения некоторых реакций можно зависать с разным соотношением количеств исходных веществ и продуктов реакции, например:
Как вы могли бы объяснить это явление? 8.12 По энтальпийной диаграмме реакции и уравнению Аррениуса для зависимости скорости реакции от температуры покажите справедливость принципа Ле-Шателье. 8.13 При повышении температуре на 30°К скорость реакции выросла в 8 раз. Рассчитайте температурный коэффициент реакции и энергию активации при 300°К. 8.14 Рассчитайте энергии активации реакций, если их температурные коэффициенте при 300°К равны 0,5; 1; 2; 4. 8.15 Константы скорости некоторой реакции при 273°К и 373°К равны, соответственно, 3,4 и 27,6. Найдете значение константы скорости этой реакции при 298°К. 8.16 Термическое разложение уксусного альдегида проходит по уравнению
Напишите кинетическое уравнение реакции. Каков порядок реакции? Рассчитайте константу скорости реакции. Рассчитайте скорость разложения при начальной концентрации альдегида 0,1 м/л и 1,0 м/л.
8.17 Скорость реакции
Определите константу скорости реакции, порядок реакции, период полураспада давление в системе через 20 мин. после начала реакции.
8.18 Рассмотрите с точки зрения химической кинетики процессы разжигания и горения костра: а) почему для разжигания костра используют тонкие веточки или бересту? б) почему ветер гасит горящую спичку, но раздувает костер? в) почему плохо горит костер из сырых дров?
Справочные таблицы |
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 174. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ? При
? При  ? При
? При  ?
? процессов?
процессов? и
и  . В чем разница между ними?
. В чем разница между ними?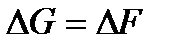 ?
?  ?
?  ?
?  ?
? . Что можно сказать об устойчивости этих соединений? Как их можно получить?
. Что можно сказать об устойчивости этих соединений? Как их можно получить? ?
? процесса?
процесса? определяет направление процесса?
определяет направление процесса?

 в процессе нагрева 300 г.
в процессе нагрева 300 г.  от 20℃ до 40℃.
от 20℃ до 40℃.




 и
и 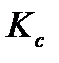 ? Как связаны эти величины? В каких случаях
? Как связаны эти величины? В каких случаях  ?
? для реакций:
для реакций: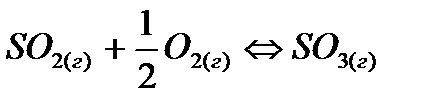 /
/  /
/ /
/  /
/ /
/  /
/ .
. и
и  реакции по табличным термодинамическим данным? Что вы можете сказать о точности полученных значений?
реакции по табличным термодинамическим данным? Что вы можете сказать о точности полученных значений? и
и  при температуре около 1000℃, подавать поток
при температуре около 1000℃, подавать поток  , то в выходящем газе содержатся пары
, то в выходящем газе содержатся пары  . Если при тех же условиях в трубку подавать пары
. Если при тех же условиях в трубку подавать пары  , то в выходящих газах обнаруживается
, то в выходящих газах обнаруживается  . Таким образом реакция
. Таким образом реакция  проходит при одной и той же температуре, либо слева направо, либо справа налево. Объясните это явление. Что можно сказать о
проходит при одной и той же температуре, либо слева направо, либо справа налево. Объясните это явление. Что можно сказать о  реакции?
реакции?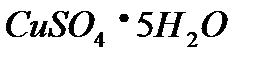 возрастает. Экзотермическим или эндотермическим процессом является дегидратация
возрастает. Экзотермическим или эндотермическим процессом является дегидратация  .
.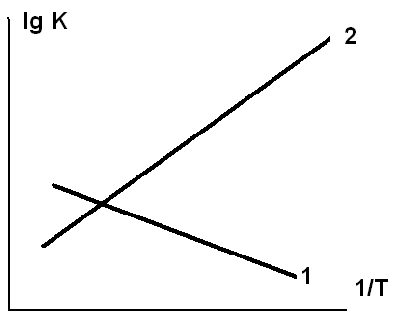 4.12. Зависимость константы равновесия от температуры можно выразить уравнением
4.12. Зависимость константы равновесия от температуры можно выразить уравнением  . Таким образом, зависимость
. Таким образом, зависимость  от 1/Т представляетпрямую линию, как показано на рисунке. Чем отличаются реакции, характеристики которых представлены прямыми 1 и 2?
от 1/Т представляетпрямую линию, как показано на рисунке. Чем отличаются реакции, характеристики которых представлены прямыми 1 и 2? при добавлении в систему инертного газа при
при добавлении в систему инертного газа при  ? При
? При  ?
? , если ввести туда некоторое количество
, если ввести туда некоторое количество  ?
?





 и 2 л.
и 2 л.  при давлении 1 атм. Какое давление установится в сосуде после протекания реакции и установлении начальной температуры?
при давлении 1 атм. Какое давление установится в сосуде после протекания реакции и установлении начальной температуры? . Если смешать по 2 моля A и B, то к моменту равновесия прореактирует 0,5 моля A. Найдите константу равновесия.
. Если смешать по 2 моля A и B, то к моменту равновесия прореактирует 0,5 моля A. Найдите константу равновесия. и 1 моля
и 1 моля  в 1 литре после протекания реакции содержится 1,6 моля
в 1 литре после протекания реакции содержится 1,6 моля  . Рассчитайте состав смеси, образующейся при этой температуре, если смешаны (2 моля
. Рассчитайте состав смеси, образующейся при этой температуре, если смешаны (2 моля  и 3 моля
и 3 моля  ) 2 моля
) 2 моля 
 , если смешаны по 3 моля A, B и C.
, если смешаны по 3 моля A, B и C. над
над  при 100℃? Как изменится равновесие, если при
при 100℃? Как изменится равновесие, если при ?
? при 1000℃.
при 1000℃. ;
;  ;
;  ?
? ? Какие фазы могут существовать в этой системе?
? Какие фазы могут существовать в этой системе? /1,82/
/1,82/ /0,92/
/0,92/ при 100℃. При какой температуре закипит раствор?
при 100℃. При какой температуре закипит раствор? процесса диссоциации уксусной кислоты из константы диссоциации. Что можно сказать о самопроизвольности процесса диссоциации?
процесса диссоциации уксусной кислоты из константы диссоциации. Что можно сказать о самопроизвольности процесса диссоциации? при изменении коэффициента?
при изменении коэффициента? концентрацией 0,5М. рассчитайте изотонический коэффициент и кажущуюся степень диссоциации в растворе HCl. Что является причиной неточности расчета?
концентрацией 0,5М. рассчитайте изотонический коэффициент и кажущуюся степень диссоциации в растворе HCl. Что является причиной неточности расчета? концентрацией 7,2% замерзает при -5℃. Найти изотонический коэффициент и кажущуюся степень диссоциации в растворе.
концентрацией 7,2% замерзает при -5℃. Найти изотонический коэффициент и кажущуюся степень диссоциации в растворе. М?
М?  М?
М?  М?
М? М?
М? 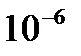 М?
М?  М?
М? М? возможно ли в этом случае применить уравнение Оствальда? Почему?
М? возможно ли в этом случае применить уравнение Оствальда? Почему? М равен 4. Найти константу диссоциации кислоты.
М равен 4. Найти константу диссоциации кислоты. и 0,01 М
и 0,01 М 
 и 0,01 М
и 0,01 М 
 М HCl и 0,01 М NaCl
М HCl и 0,01 М NaCl
 и 0,01 М
и 0,01 М 
 ?
?  ?
? можно растворить в 5 л. воды?
можно растворить в 5 л. воды? -
-  моль/литр. Рассчитайте произведение растворимости
моль/литр. Рассчитайте произведение растворимости  и pH насыщенного раствора.
и pH насыщенного раствора. в насыщенном растворе
в насыщенном растворе  , если раствор содержит еще
, если раствор содержит еще  концентрацией 5г/л. степень диссоциации
концентрацией 5г/л. степень диссоциации  принять равной 1.
принять равной 1. при сливании 0,5 л. раствора
при сливании 0,5 л. раствора  концентрацией 0,5 г/л. и 1 л. раствора
концентрацией 0,5 г/л. и 1 л. раствора  концентрацией 0,1 г/л. вычислить концентрации всех ионов, находящихся в растворе.
концентрацией 0,1 г/л. вычислить концентрации всех ионов, находящихся в растворе. , если в раствор, находящийся в равновесии с твердым
, если в раствор, находящийся в равновесии с твердым  ввести
ввести  ?
? ,
,  ,
,  ,
, 
 ,
,  ,
,  ,
, 
 ,
,  ,
,  ,
, 
 ,
,  ,
,  ,
, 








 . Какими будут равновесные концентрации, если исходные концентрации
. Какими будут равновесные концентрации, если исходные концентрации  и
и  равны 1 М?
равны 1 М?



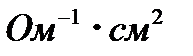 , а 0,5 М – 77,5
, а 0,5 М – 77,5 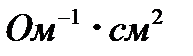 .
. начальные концентрации А и В равны соответственно 0,8 и 2,0 моль/л. Через 20 мин. концентрация А стала равной 0,6 моль/л. Найти концентрации В и D в это время и среднюю скорость реакции.
начальные концентрации А и В равны соответственно 0,8 и 2,0 моль/л. Через 20 мин. концентрация А стала равной 0,6 моль/л. Найти концентрации В и D в это время и среднюю скорость реакции. , если в систему ввести некоторое количество аргона при
, если в систему ввести некоторое количество аргона при  ? При
? При  ?
? в растворе уксусной кислоты происходит скорее, чем в растворе серной кислоты, хотя серная кислота является сильной, а уксусная слабой. Объясните это явление.
в растворе уксусной кислоты происходит скорее, чем в растворе серной кислоты, хотя серная кислота является сильной, а уксусная слабой. Объясните это явление.

 . При 800°К получены следующие данные по зависимости скорости разложения от концентрации альдегида
. При 800°К получены следующие данные по зависимости скорости разложения от концентрации альдегида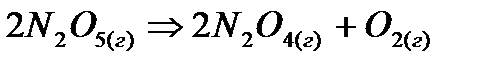 можно определить по общему давлению в системе. При 328°К были получены следующие данные:
можно определить по общему давлению в системе. При 328°К были получены следующие данные: