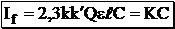Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Классификация видов люминесценцииПонятие “люминесценция” включает в себя множество различных явлений. Существует несколько систем их классификации.
В аналитической химии чаще всего используется молекулярная фотолюминесценция. В зависимости от природы основного и возбуждённого состояния молекулы её подразделяют на флуоресценцию и фосфоресценцию. 21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция При поглощении кванта света молекула вещества переходит из основного электронного состояния в возбуждённое. Одной из характеристик электронного состояния является мультиплетность
где S - суммарный спин данного электронного состояния.
Основное состояние молекулы обычно является синглетным. Возбуждённые состояния могут быть как синглетными, так и триплетными, причём возбуждённое триплетное состояние имеет немного меньшую энергию, чем соответствующее ему синглетное. Для описания физических процессов, которым подвергаются молекулы в возбуждённом состоянии, обычно используют энергетические диаграммы типа показанной на рис. 21.3. Когда молекула поглощает свет, она за очень короткое время (~10-15 с) переходит на какой-то колебательный и вращательный уровень одного из возбуждённых синглетных состояний (обычно S1 или S2). Далее с возбуждённой молекулой могут происходить 2 типа процессов: безызлучательные (показаны на диаграмме волнистой линией) и излучательные (показаны на диаграмме прямой линией). Молекула может отдавать свою энергию небольшими порциями (например, при столкновении с другими молекулами). При этом электрон возвращается с более высоких колебательных уровней на более низкие в пределах данного электронного уровня. Такой процесс называется колебательной релаксацией. Безызлучательный переход между состояниями, имеющими одинаковую энергию и одинаковую мультиплетность, называется внутренней конверсией. Безызлучательный переход между состояниями, имеющими одинаковую энергию, но разную мультиплетность называется интеркомбинационной конверсией.  Флуоресценция -излучательный переход между состояниями, имеющими одинаковую мультиплетность. В подавляющем большинстве случаев флуоресценция сложных органических молекул обусловлена переходом с нулевого колебательного уровня возбуждённого состояния S1 на какой-то из колебательных уровней S0, реже S2 ®S0 (например, в молекуле азулена) и очень редко Sk ®Sm или Tm ®Tn. Флуоресценция - быстрый процесс (10-9 - 10-6 с). Фосфоресценция -излучательный переход между состояниями, имеющими разную мультиплетность. Обычно фосфоресценции соответствует переход T1 ® S0. Переходы между состояниями с различной мультиплетностью имеют очень малую вероятность, то есть являются “запрещёнными”. Излучательный переход, обуславливающий фосфоресценцию, имеет ~ в 106 раз меньшую вероятность, чем переход, определяющий флуоресценцию, поэтому фосфоресценция имеет гораздо большую длительность (в среднем 10-3 - 10 с), чем флуоресценция. 21.2.3 Основные характеристики и закономерности люминесценции Основными характеристиками люминесценции являются: · спектр возбуждения, · спектр испускания (спектр люминесценции), · квантовый и энергетический выходы, · поляризация, время жизни и т.д. Спектр возбуждения люминесценции (флуоресценции, фосфоресценции) - зависимость интенсивности испускаемого света с фиксированной длиной волны от длины волны или другой волновой характеристики возбуждающего света. Возбуждая молекулу вещества светом с длиной волны, соответствующей lmax спектра возбуждения, можно получить флуоресценцию с максимальной интенсивностью. В разбавленных растворах спектр возбуждения флуоресценции совпадает со спектром поглощения вещества. Спектр люминесценции- зависимость интенсивности испускаемого света от его длины волны при фиксированной длине волны возбуждающего света. В табл. 21.1 приведены основные свойства, присущие спектрам люминесценции. Табл. 21.1. Основные свойства спектров люминесценции
Квантовый выход(обозначение Вкв, Q, f) - отношение числа испускаемых фотонов к числу поглощаемых Энергетический выход(Вэн) - отношение энергии излучаемого света к энергии поглощаемого
Между Вкв и Вэн существует следующая взаимосвязь
Поскольку обычно nисп < nпогл, то Вэн < Вкв Квантовый выход люминесценции не зависит от lвозб вплоть до некоторой l, находящейся в области наложения спектров поглощения и испускания, после чего резко уменьшается.Энергетический выход зависит от lвозб: вначале он увеличивается прямо пропорционально lвозб , затем на некотором интервале не изменяет своей величины, после чего резко уменьшается (закон Вавилова). 21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов Люминесценция и, в частности, флуоресценция в гораздо большей степени подвержена влиянию различных факторов, чем поглощение света. Интенсивность флуоресценции зависит от: · природы вещества; · концентрации вещества в растворе; · условий, в которых находится флуоресцирующее вещество (температура, растворитель, рН, наличие в растворе других веществ, способных влиять на флуоресценцию). Природа вещества Неорганические соединения (за исключением некоторых соединений урана, лантанидов) обычно не способны флуоресцировать в растворе. В то же время среди органических соединений флуоресцирующих веществ достаточно много. Необходимым (но не достаточным!) условием для фотолюминесценции является способность вещества поглощать электромагнитное излучение УФ- или видимого диапазона. Обычно вещества, обладающие интенсивной флуоресценцией, имеют длинную систему сопряжённых связей. Наиболее часто флуоресцирующие вещества встречаются среди ароматических соединений. Введение в бензольное кольцо электронодонорных заместителей увеличивает способность вещества флуоресцировать. Например, многие фенолы и ароматические амины обладают интенсивной флуоресценцией. Введение электроноакцепторных заместителей, за некоторым исключением, уменьшает флуоресценцию. Атомы тяжёлых галогенов (Br, I) увеличивают скорость интеркомбинационной конверсии и, тем самым, уменьшают квантовый выход флуоресценции. Однако введение тяжёлых галогенов увеличивает способность вещества фосфоресцировать. Способность вещества к флуоресценции в растворе увеличивается при конденсации ароматических колец и увеличении «жёсткости» молекулы. Например
Концентрация вещества Зависимость между интенсивностью флуоресценции и концентрацией флуоресцирующего вещества в растворе более сложная, чем между поглощением света и концентрацией. Это связано с тем, что процесс излучения является вторичным и зависит от предшествующего ему процесса поглощения света. Рассмотрим простейший случай, когда в растворе находится только одно флуоресцирующее вещество.
Таким образом:
Следовательно, зависимость между интенсивностью флуоресценции и концентрацией флуоресцирующего вещества не является линейной. Функцию
Если произведение
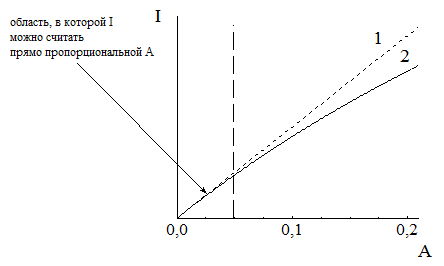
Таким образом, при малых значениях оптической плотности (при lвозб) зависимость интенсивности флуоресценции от концентрации можно считать линейной, что и используется в количественном анализе. При более высоких значениях A зависимость интенсивности флуоресценции от концентрации становится более сложной и отклоняется от линейной. При A = 0,01 отклонение от линейности составляет 1%, 0,05 - 5%; 0,5 - около 35% (рис. 21.4).
Рис. 21.4. Зависимость между интенсивностью флуоресценции и оптической плотностью раствора 1) рассчитанная по упрощённой формуле I = KC; 2) реальная Влияние оптической плотности раствора на интенсивность флуоресценции называется «эффектом внутреннего фильтра». Этот эффект обусловлен двумя причинами: · поглощением возбуждающего света, вследствие чего частицы, находящиеся дальше от источника излучения, будут получать меньше возбуждающего излучения; · поглощением одними частицами вещества излучения, испускаемого другими частицами этого же вещества. |
|||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 235. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


 ,
,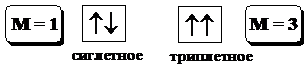

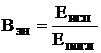
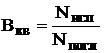
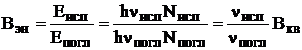

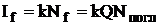
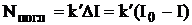
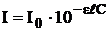
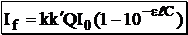
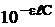 можно разложить в ряд Маклорена
можно разложить в ряд Маклорена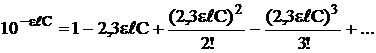
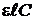 (оптическая плотность раствора) невелико, то
(оптическая плотность раствора) невелико, то  и тогда
и тогда