
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Направление протекания окислительно-восстановительных реакцийКритерием самопроизвольного протекания химических процессов является изменение свободной энергии Гиббса (ΔG < О). Изменение энергии Гиббса ОВР связано с разностью окислительно-восстановительных (электродных) потенциалов участников окислительно-восстановительного процесса Е:
где F – постоянная Фарадея; n – число электронов, участвующих в окислительно-восстановительном процессе; Е – разность окислительно-восстано-вительных потенциалов или электродвижущая сила ОВР (ЭДС гальванического элемента, образованного двумя окислительно-восстановительными системами): Е = j0 – jВ, где j0 – потенциал окислителя, jВ – потенциал восстановителя. Учитывая вышеизложенное: ОВР протекает в прямом направлении, если ее ЭДС положительна, т.е. Е>О; в противном случае (Е<О) ОВР будет протекать в обратном направлении. ЭДС, вычисленная для стандартных условий, называется стандартной и обозначается Е Пример 1: Определите, возможно ли протекание реакции в прямом направлении при стандартных условиях: 2Fe3+ + 2 I При протекании реакции в прямом направлении окислителем будут являться ионы Fe3+, восстановителем – иодид-ионы (I
Ответ: протекание данной реакции возможно только в прямом направлении. Пример 2. Определите направление протекания реакции при стандартных условиях: 2KCI + 2MnCI2 + 5CI2 + 8H2O D 2KMnO4 + 16HCI. Предположим, что реакция протекает в прямом направлении, тогда
Протекание реакции в прямом направлении невозможно. Она будет протекать справа налево, в этом случае Ответ: данная реакция протекает справа налево. Таким образом, реакция будет протекать в направлении, в котором ЭДС положительна. Всегда системы с более высоким окислительно-восстановительным потенциалом будут окислять системы с более низким его значением. 
Электрохимические процессы Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз). Электрохимическая система состоит из двух электродов и ионного проводника между ними (расплав, раствор электролита или твёрдые электролиты – проводники 2-го рода). Электродами называют проводники первого рода, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Для обеспечения работы электрохимической системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 200. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
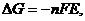
 .
.
 D 2Fe2+ + I2.
D 2Fe2+ + I2.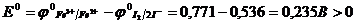 .
. .
. .
.