
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Метод электронного баланса.Здесь подсчет числа присоединяемых и теряемых электронов производится на основании значений степеней окисления элементов до и после реакции. Обратимся к простейшему примеру: Na0 + Cl
1 Cl2 + 2eˉ ® 2 Cl
2 Na + Cl2 = 2NaCl Данный метод используют в том случае, если реакция протекает не в растворе (в газовой фазе, реакции термического разложения и т.д.). Алгоритм подбора коэффициентов в уравнениях ОВР методом электронного баланса: 1. Записать молекулярную схему реакции. 2. Определить с.о. элементов. 3. Отметить символы элементов, изменивших с.о. в ходе реакции. 4. На основании сравнения с.о. элементов, определить окислитель и продукт восстановления, восстановитель и продукт окисления. 5. Составить электронные уравнения процессов восстановления, окисления, соблюдая при этом баланс по элементам и зарядам. 6. Найти наименьшее общее кратное (НОК) для числа принятых и отданных электронов. 7. Найти основные коэффициенты при каждом электронном уравнении. Для этого полученное в пункте 6 число НОК разделить на число электронов, фигурирующих в данном электронном уравнении. 8. Умножить электронные уравнения на основные коэффициенты, полученные в п.7, и просуммировать их между собой (т.е. получить суммарное электронное уравнение). В суммарном уравнении электроны отсутствуют, т.к. сокращаются. 9. Подставить коэффициенты из суммарного электронного уравнения в молекулярное уравнение. Остальные коэффициенты подбираем в последовательности: соль, кислота или основание, вода.  10. Осуществить проверку числа атомов кислорода в правой и левой частях уравнения. Примеры: 1. Молекулярная схема реакции: +3 +2 0 +4 BiCl3 + Na2SnO2 + NaOH → Bi + NaCl + Na2SnO3 +H2O ок-ль восст-ль продукт продукт восст-ия ок-ия Электронные уравнения:
Молекулярное уравнение реакции: 2BiCl3 + 3Na2SnO2 + 6NaOH → 2Bi + 6NaCl + 3Na2SnO3 +3H2O Проверка: O: 12 = 12. |
|||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 223. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ® Na+ Cl
® Na+ Cl 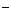


 2 Na + Cl2 = 2Na+ + 2Cl
2 Na + Cl2 = 2Na+ + 2Cl