
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
G: аморфный углерод, h: углеродная нанотрубкаПроисхождение названия Международное название происходит от латинскогоcarbo — уголь, связанного с древним корнемkar — огонь. Этот же корень в латинскомcremare— гореть, а возможно, и в русском «гарь», «жар», «угореть» (в древнерусском «угорати» — обжигать, опалять). Пётр I впервые познакомился с углём в 1696 году, возвращаясь из первого Азовского похода в районе нынешнего г. Шахты (до революции Александровск-Грушевск). Во время отдыха на берегу Кальмиуса царю показали кусок чёрного, хорошо горящего минерала. «Сей минерал, если не нам, то потомкам нашим зело полезен будет», — сказал Пётр I. Рудознавец крепостной крестьянин Григорий Капустин в 1721 году открыл каменный уголь близ притока Северского Донца — реки Курдючьей и доказал его пригодность для использования в кузнечном и железоделательном производствах. В декабре 1722 года Петр I именным указом послал Капустина за пробами угля, а затем было предписано снаряжение специальных экспедиций для разведки угля и руды. Группа С. Костылева в 1720—1721 годах вела поиски полезных ископаемых в северных предгорьях Алтая. В феврале 1722 года М. Волков сделал заявку на железную руду, найденную им в Томском уезде, и уголь, обнаруженный им в «горелой горе» в семи верстах от Верхотомского острога, на территории современного города Кемерово.
Углеграфитовые материалы изготавливаются из веществ, основным химическим элементом которых является углерод. Углерод с атомным номером 6 имеет атомную массу 12,011. На его долю приходится 0,14 % земной коры. Он содержит 98,9% изотопа 12С с 1,1% изотопа 13С. масса первого принята за единицу атомных и молекулярных масс. В природе существует в виде аллотропных модификаций: алмаза и графита. Природные графиты имеют в своём составе следы радиоактивного изотопа 14С и несколько других менее стабильных изотопов. Выше температуры 1800 °С алмаз быстро переходит в графит. В среде кислорода температура перехода быстро снижается. Диаграмма состояния графита приведена на рис. 1. Тройная точка «алмаз-графит-жидкий углерод» имеет координаты: температура 3700 К, давление 22 ГПа.  Все газы, содержащие кислород, кроме СО, являются окислителями для графита при соответствующих температурах. С азотом графит реагирует при температурах сублимации см. рис. 2.
Предельные температуры существования графитовых деталей в современной технике определяются температурами сублимации твёрдого углерода. Скорость сублимации в инертных газах и на воздухе тем больше, чем меньше молекулярная масса окружающего газа и чем ниже внешнее давление. При давлении 10 МПа имеем картину рис. 3.
В интервале температур от комнатной до 2800 К углеродные материалы не имеют сравнимых прототипов по удельной прочности, измеренной, например в км.См. рис. 4. Всё изложенное определяет предпосылки создания на основе углерода жаростойких конструкционных материалов. работоспособных в широком интервале температур.
Схемы строения различных модификаций углерода A: алмаз, b: графит, c: лонсдейлит D: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70 g: аморфный углерод, h: углеродная нанотрубка
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кгна 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
В пределах кристаллита электроны образуют гибридные электронные sp3 – орбитали. Атомы углерода в этом состоянии образуют кубическую гранецентрированную решётку алмаза, состоящую из регулярных тетраэдров. В молекуле фуллерена за счёт объёмной гибридизации электрононных орбит имеет место их высокая электроотрицательность (причина способности поглощения больших объёмов водорода молекулой), а так же относительно высокотемпературная (около +100 К) молекулярная сверхпроводимость. Всего молекула фуллерена С60 содержит 20 шестичленных и 12 пятичленных колец. Сферы через свои не скомпенсированные p-связи упакованы в гранецентрированную или гексагональную объёмно-центрированную решётку. Фуллерены на сегодня являются единственной стабильной формой углерода. Алмаз и другие формы углерода, кроме фуллеренов, термодиномически метастабильны. При нагревании все они переходят в равновесную форму – графит (см. рис.5). Атомы углерода имеют в слое графита sp2-гибридизацию трёх электронов s-связи каждого атома. Четвёртый электрон p-связи обеспечивает молекулярную межслоевую связь Ван-дер-Ваальсовой природы. Энергия межмолекулярных связей p-связи на порядок меньше энергии s-связи, соответственно, 0.27-0.4 и 2.6-3.2 эВ. При увеличении расстояния d002 (см. рис.5) энергия p-связи ещё уменьшается. Сдвиг атомов каждого последующего слоя атомов углерода в графите происходит по осям X иY так, что атомы каждого третьего слоя повторяют первый слой. В бездефектной кристаллической решётке некомпланарность между плоскостями не превышает ±10-4 нм. В реальной решётке содержатся дислокации; атомные вакансии; атомы углерода, располагающиеся между слоями; межкристаллитные и внутрикристаллитные поры; азимутальная разориентация слоёв углеродных сеток и, наконец, искривления границ между кристаллитами. В пределах внутри этих дефектов пачки углеродных атомов формируют область когерентного рассеяния монохроматического рентгеновского потока, размеры которой дают при рентгеновском контроле величины La и Lc (см. рис. 5). Искусственные углеграфитовые материалы получают из углеродсодержащих органических веществ: нефтяные и каменноугольные пеки; фенол-формальдегидные и эпокси-фенольные смолы; гидратцеллюлоза; полиакрилнитрил; газообразные углеводороды; сланцевый кокс; антрацит и т.п. По мере технологических операций в структуре исходных веществ происходят термо-химические превращения, завершающиеся формированием кристаллической структуры графита. Однако степень совершенства этой структуры (степень приближения к структуре монокристалла графита, в котором, в первую очередь, достигается минимальное значение d 002, равное 0.335 нм, и указанное выше «правильное» чередование первых и третьих слоёв между собой) достигается постепенно. Для некоторых видов исходных материалов, а именно – фенолформальдегидной смолы и гидратцеллюлозы, это состояние углеродного вещества недостижимо при температурах обработки вплоть до температур сублимации. И, напротив, для таких веществ как каменноугольные и нефтяные пеки углеродное вещество превращается в вполне совершенный кристаллический графит при сщественно меньших температурах обработки. В обоих случаях проведение термохимической обработки под давлением, особенно на этапах проявления вынужденноэластических деформаций процесс ускоряется или протекает до более глубоких превращений углеродного вещества в кристаллический графит. На этапе формирования «правильного» чередования углеродных сеток, азимутальная разориентация последних упорядочивается, и атомы углерода занимают в пространстве места вершин тетраэдра, устанавливается sp3 гибридизация электронного облака, что отражается в достижении минимального уровня d 002 , равного 0.335 нм, и максимального уровня магнитной восприимчивости углеграфитового вещества, равного 7.10-6 ед. CGSE/г. Последнее свидетельствует о завершении формирования обобщённых молекулярных орбит кристаллита, который в таком случае можно уже рассматривать как макромолекулу углерода. Графе́н (англ. graphene) — слой атомов углерода, соединённых посредством sp² связей в гексагональную двумерную кристаллическую решётку. Его можно представить как одну плоскость графита, отделённую от объёмного кристалла. По оценкам, графен обладает большой механической жёсткостью и хорошей теплопроводностью (~1 ТПа[3] и ~5×10³ Вт·м−1·К−1[4] соответственно). Высокая подвижность носителей тока при комнатной температуре делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники[5] и возможную замену кремния в интегральных микросхемах.
Для получения нанотрубки (n, m), графитовую плоскость надо разрезать по направлениям пунктирных линий и свернуть вдоль направления вектора R. Свойства кристаллических форм углерода.
Анизотропия связей в кристаллите гексагонального графита приводит к характерному виду анизотропии упругих свойств, а так же коэффициента термического линейного расширения. Так матрица модуля упругости монокристалла графита в ГПа имеет вид, показанный в таблице.
Для наиболее текстурированного углеродного высопрочного высокомодульного волокна имеем матрицу упругости. наиболее приближённую к представленной. Различия связаны с разориентацией внутренних слоёв кристаллитов от аксиального направления.
Для поликристаллического графита. имеющего степень текстурирования ещё менее до 0,35 имеем практически изотропную матрицу упругости.
Кривые деформирования при сверхвысоких температурах испытания указывают на проявление ползучести. (Материал МПГ-8)
Сублимация графита – это ещё не конец его существования. Он возрождается в форме нанопродуктов
Самый распространённый метод получения углеродных нанотрубок — синтез в плазме дугового разряда между графитовыми электродами в атмосфере гелия. Типичная схема электродуговой установки для изготовления
Рис. 3. Схема установки для получения нанотрубок электродуговым методом. Материала, содержащего нанотрубки и фуллерены, а также другие углеродные образования, показана на рис. 3. Дуговой разряд возникает и горит в камере с охлаждаемыми водой стенками при давлении буферного газа (гелий или аргон) порядка 500 Торр. Обычно межэлектродное расстояние равно 1–2 мм; оно устанавливается автоматически. Чтобы получить максимальное количество нанотрубок, ток дуги должен быть 65–75 А, напряжение — 20–22 В, температура электронной плазмы — порядка 4000 К. В этих условиях графитовый анод интенсивно испаряется, поставляя отдельные атомы или пары атомов углерода, из которых на катоде или на охлаждённых водой стенках камеры и формируются углеродные нанотрубки. В большинстве случаев на катоде образуется твёрдый депозит-осадок макроскопического размера (в виде плоского пятна диаметром 11–12 мм и толщиной до 1–1.5 мм). Он состоит из наносвязок — нитей длиной 1–3 мкм и диаметром 20–60 нм, содержащих 100–150 уложенных в гексагональную упаковку однослойных или многослойных нанотрубок. Такие связки напоминают связки круглых брёвен, которые перевозят на лесовозах, или сплавляющиеся плоские плоты из брёвен. Нити наносвязок и отдельные нанотрубки часто образуют беспорядочную (а иногда и упорядоченную) сеть, похожую на паутину. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 175. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

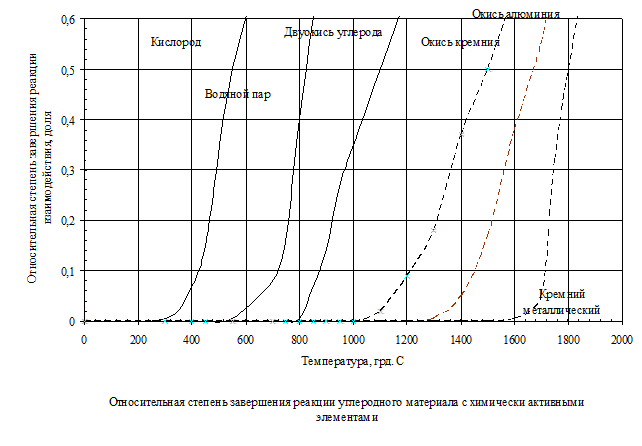




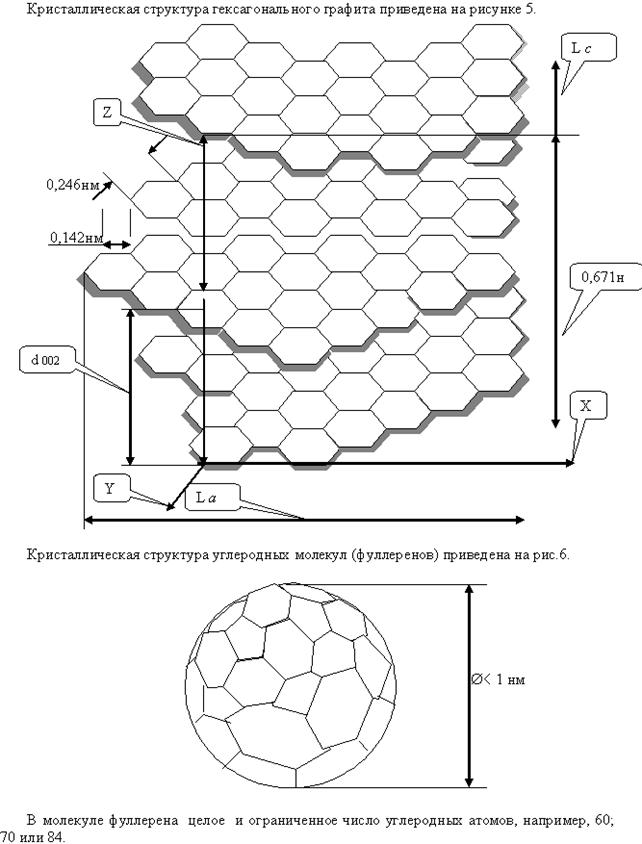
 Рис. 1. Идеальная кристаллическая структура графена представляет собой гексагональную кристаллическую решётку.
Рис. 1. Идеальная кристаллическая структура графена представляет собой гексагональную кристаллическую решётку.





