Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Испытания на цитотоксичностьСтр 1 из 2Следующая ⇒ Испытания токсичности Испытание на аномальную токсичность проведено в соответствии с Государственной Фармакопеей Российской Федерации XIIIиздание, том I (ОФС.1.2.4.0004.15). Испытание проводили на двух видах животных: белых мышах массой (18-20) г и морских свинках массой (250-300) г. Исходную массу животных определяли и регистрировали в день начала испытаний. В исследованиях были использованы здоровые животные, содержащиеся на регламентированном пищевом рационе, которые ранее не использовались для проведения каких-либо испытаний. Описание образца: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во флаконах по 3мл. по ТУ 9385-059-05664012-2017, экспериментальная серия. Препарат вводили подкожно по 1,0 мл двум морским свинкам и внутрибрюшинно по 1,0 мл пяти белым мышам со скоростью 0,1 мл/сек. Наблюдение за животными осуществляли ежедневно в течение 7 дней с регистрацией всех изменений в состоянии здоровья каждого животного. Через 1 сутки, 4 дня и в день окончания наблюдения каждое животное взвешивали. Учет результатов:Испытание считают удовлетворительным, если: - все животные остаются живыми в течение периода наблюдения; - ни у одного из животных не выявлены признаки заболевания, интоксикации; - ни у одного из животных, получивших испытуемый препарат подкожно, не развился некроз или абцесс в месте его введения; -масса каждого животного в день окончания наблюдения не уменьшилась по сравнению с исходной. Заключение: Исследуемый препарат в дозе 1 мл/животное нетоксичен (результаты контроля приведены в приложении к протоколу). Приложение к протоколу Результаты контроля токсичности 
Испытания на пирогенность Испытание на пирогенность проведено в соответствии с Государственной Фармакопеей Российской Федерации XIIIиздание, том I (ОФС.1.2.4.0005.15). Описание образца: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во флаконах по 3мл. по ТУ 9385-059-05664012-2017, экспериментальная серия. Испытание на пирогенность основано на измерении температуры тела у кроликов до и после инъекции.Испытуемое инъекционное средство вводили в ушную вену кролика в дозе 1 мл/животное.Перед введением раствор подогревали до 37,0±2 оС.Испытание инъекционного средства проводили на группе из трех кроликов и исходной температурой 38,5-39,5 оС.Перед опытом, с интервалом не менее 30 мин, у каждого кролика дважды измеряли температуру тела. Различия в показаниях температуры у одного и того же животного не превышали 0,2 оС. За исходную температуру принимали величину последнего результата измерения. Раствор испытуемого средства вводили животным сразу после второго измерения температуры. Измерения температуры после внутривенного введения испытуемого средства проводили с интервалом не более 30 мин на протяжении трех часов. Учет результатов:Определяли максимальное изменение температуры (дельта t) тела каждого кролика по сравнению с исходным значением. В соответствии с требованиями Государственной Фармакопеи Российской Федерации изменение температуры тела животного ниже исходной величины принимают за нуль и не учитывают. При испытании на 3-х кроликах инъекционное средство признают апирогенным, если полученный результат меньше или равен 1,2 оС, а индивидуальное повышение температуры ни у одного из кроликов не превышает 0,5 оС. Заключение:Исследуемый препарат в дозе 1 мл/животное непирогенен. Максимальное повышение температуры у кроликов по сравнению с исходным значением составило 0,2 оС и индивидуальное повышение температуры ни у одного из кроликов не превысило 0,5 оС. Результаты контроля приведены в приложении к протоколу. Приложение к протоколу Результаты контроля пирогенности
Испытание на стерильность Испытание на стерильность проведено в соответствии с Государственной Фармакопеей Российской Федерации XIII издание, том I (ОФС.1.2.4.0003.15). Описание образца: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во флаконах по 3мл. по ,ТУ 9385-059-05664012-2017 экспериментальная серия. Испытание на стерильность проводили методом прямого посева. Посевы инкубировали в течении 14 суток при температуре 32,5 ± 2,5оС в жидкой тиогликолевой среде и при температуре 22,5 ± 2,5оС в среде Сабуро. Заключение:Исследуемый препаратстерилен.
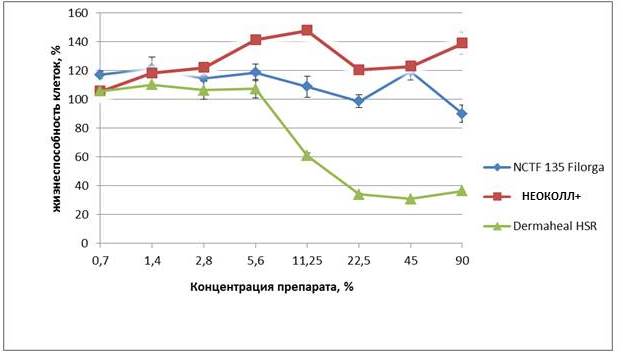
Протокол определенияводородного показателя pH Потенциометрическое определение pH проведено в соответствии с Государственной Фармакопеей Российской Федерации XIII издание, том I ОФС.1.2.1.0004.15 Ионометрия. Описание образца: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во флаконах по 3мл. поТУ 9385-059-05664012-2017, экспериментальная серия. Измерение проведено на измерителе комбинированном Seven(модификация SevenEasy) в комплекте с электродом, производства MettlerToledoInlabMicro № 3221186. Перед испытаниями была проведена калибровка pH-метра и электрода по трем стандартам буферным растворам, которые охватывают интервал измерений pHданного препарата. Заключение: значение pHпредставленного препарата составило 7,2 ед. pH. Испытания на цитотоксичность Испытание на цитотоксичность проведено в соответствии сГОСТ ISO 10993-5-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro». Описание образца: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во флаконах по 3мл. по ТУ 9385-059-05664012-2017, экспериментальная серия. Линия клеток: DK-4 штамм диплоидных клеток из кожно-мышечной ткани эмбриона человека получен из коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Клетки фибробластоподобные с ядрами овальной формы. Монослойный способ культивирования. Бактерии, грибы, микоплазмы и вирусы в культуре клеток не обнаружены. Условия культивирования: Клетки выращивали в ростовой питательной среде Игла МЕМ (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) с 10 % сыворотки крови плодов коровы (Gibco, США), 200 мМ L-глютамина, 40 мкг/мл гентамицина в CO2 инкубаторе при 37 оС. Посевная концентрация составляла (0,5-1,0)х106 клеток в 1 мл, кратность рассева 1:3, клетки пересевали каждые 3 − 4 суток. Для пересева культур клеток в качестве диспергента применяли 0,25 %-ный раствор трипсина (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) и 0,02 %-ный раствор версена (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) в соотношении 1:2. Контроли. В качестве контролей использована ростовая питательная среда с 10 % сыворотки.Вкачестве препарата сравнения использован «Имплантат для подкожного введения NCTF 135 во флаконах объемом 5мл» производства FilorgaS.A.S. 2-4, ruedeLisbonne 75008 Paris (Франция), Регистрационный номер медицинского изделия ФСЗ 2008/02524, а также препарат «DermahealHSR» производства Caregen (республика Корея). Клеточный ответ оценивали с помощью МТТ-теста.Исследование цитотоксичности препарата проводили с использованием МТТ-теста. Клетки рассевали в 96-луночные культуральные планшеты в концентрации 7 – 10 х103 клеток/лунка, инкубировали в течение 24 часов при 37оС в увлажненной атмосфере, содержащей 5% двуокиси углерода (стандартные условия). Посевная концентрация клеток устанавливалась с таким расчетом, чтобы воздействие проходило в экспоненциальной (логарифмической) фазе роста клеток. Далее в планшеты вносили препараты в широком диапазоне концентраций (0,7 – 90%) и совместно культивировали в течение 72 часа при стандартных условиях культивирования. Жизнеспособность клеток оценивали по включению клетками 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н- тетразолиум бромида (МТТ) (Sigma, США) и преобразования его в формазан митохондриальными дегидрогеназами. Для этого в каждую лунку добавляли МТТ-реагент в конечной концентрации 250 мкг/мл, инкубировали клетки в течение 4 часов, затем растворяли образовавшийся формазан 100 мкл ДМСО. Далее снимали значения оптической плотности субстрата в лунках с помощью на микропланшетном фотометре Multiskan FC (Thermo Scientific) при длине волны 492 нм. Процент жизнеспособных клеток вычисляли по формуле: оптическая плотность раствора опыта / оптическая плотность раствора контроля х 100 %. Статистические отличия рассчитывались с помощью критерия Манн-Уитни в программе Statistiсa 8.
Рис.1. Влияние препаратов на жизнеспособность фибробластоподобных клеток человека после совместной инкубации в течение 72 часов. Заключение: Экспериментально доказано, что гель для внутрикожных инъекций «НЕОКОЛЛ+» не оказывал цитотоксическое влияние на фибробласты человека, напротив показано, что препарат стимулирует пролиферацию клетокв концентрации от 2,8 – 90 % (рис.1). Тогда как, препарат «DermahealHSR» (Caregen, республика Корея) значительно снижал жизнеспособность фибробластоподобных клеток человека в дозе от 11,25 – 90 % процент жизнеспособных клеток снизился до 40 %.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 228. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||