
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет объема и состава продуктов горенияРасчет объема продуктов горения, выделяющихся в помещениях, проводится в соответствии с методикой, изложенной в [6]. Общий объём выделяющихся продуктов горения сложных веществ переменного состава складывается из объёма компонентов продуктов горения, образующихся из элементов, входящих в состав горючего вещества. При этом влажность вещества увеличивает объём образующихся продуктов горения, а входящий в его состав кислород снижает расчётное значение азота в последних. Используя коэффициенты, указанные в таблице приложения 6, определяем объём продуктов горения 1 кг вещества при нормальных условиях. Для 1 кг вещества объемы продуктов горения вычисляются по следующим формулам:
где: w(С), w(H), w(S), w(O). w (W) - массовые доли углерода, водорода, серы, кислорода и влаги в горючем веществе, %.
Если коэффициент избытка воздуха больше единицы (a > 1), то вычисленный при нормальных условиях объём избытка воздуха учитывается в общем объёме продуктов горения. Его находят по формуле:
Общий объём продуктов горения, выделяющихся при сгорании 1 кг вещества в нормальных условиях, определяем, суммируя объёмы компонентов продуктов горения:
где:
Пересчитываем общий объём продуктов горения на заданное количество вещества:
Находим объём продуктов горения при заданных условиях:
где: Vпг 0/ – объем продуктов горения, выделившейся при сгорании заданного количества вещества, м3;  Ро - давление при нормальных условиях, Па; То - температура при нормальных условиях, К; Р - заданное давление, Па; Т - заданная температура, К.
Объём компонентов продуктов горения определяется по формулам:
При нахождении процентного состава компонентов продуктов горения их общий объём j Расчет низшей теплоты сгорания и температуры горения Расчет низшей теплоты сгорания веществ, горение которых происходит в помещении (в соответствие с вариантом задания), определяется в соответствие с методикой изложенной в [9]. Для сложных веществ переменного состава, находящихся в твёрдом и жидком агрегатных состояниях, а также сложных веществ постоянного состава, теплоту сгорания рассчитывают по формуле Д.И. Менделеева. Вычисления проводят с использованием массовых долей (%), соответственно, углерода, водорода, кислорода, серы и азота в горючем веществе. Qн = 339,4 × ω(С) + 1257 × ω(Н) - 108,9 × (ω(О) + ω(N) – ω(S)) – 25,1×(9×ω(Н) + ω(W)), кДж/кг где: 339,4; 1257; 108,9; 25,1; 9 - коэффициенты при углероде, водороде, кислороде величины безразмерные; ω(С), ω(Н), ω(О), ω(N), ω(S), ω(W) - массовые доли углерода, водорода, кислорода, азота, серы, влаги в горючем веществе %. Для последующих расчетов полученную величину низшей теплоты сгорания переводят в Дж/кг. Максимальная температура, до которой нагреваются продукты горения, называется температурой горения. Расчет температуры горения веществ производится в соответствие с методикой, изложенной в [9]. Расчет параметров развития пожара |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 230. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
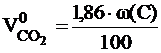
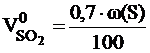
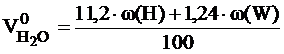
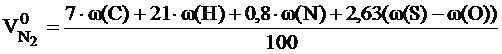

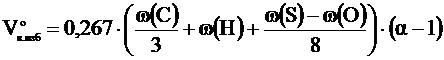 , м3
, м3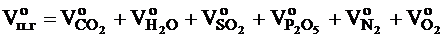 , м3,
, м3,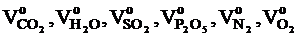 - объёмы образующихся при нормальных условиях газов: оксида углерода (IV), водяного пара, оксида серы (IV), оксида фосфора (V), азота и кислорода, м3.
- объёмы образующихся при нормальных условиях газов: оксида углерода (IV), водяного пара, оксида серы (IV), оксида фосфора (V), азота и кислорода, м3.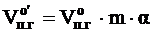 , м3
, м3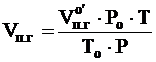 , м3
, м3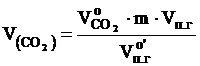 , м3;
, м3; 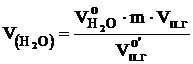 , м3 и т.д.
, м3 и т.д.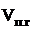 принимается за 100 % и определяется из соотношения:
принимается за 100 % и определяется из соотношения: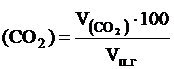 , %; j
, %; j 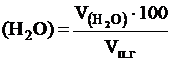 , % и т.д.
, % и т.д.