
Студопедия
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
|
РозрахуНково-графічне завдання за темою
Індивідуальні та домашні завдання для самостійної роботи студентів
| Вид та тема завдання
| Кількість
годин СР
| Діяльність студентів
| Література
| | Домашнє завдання для самостійного опрацювання окремих розділів програми:
|
| |
| | Тема 1. Значення науки для хімічної технології та охорони навколишнього середовища
| 1,5
| За допомогою спеціальної і навчальної літератури самостійно опрацювати теми та окремі питання, які не викладаються на лекціях
| [1],[2],
[3],[10]
| | Тема 2. Приклади отримання монодисперсних систем
| 1,5
|
| [1],[2],
[3],[10]
| | Тема 3. Вплив природи ад- сорбента, іонів і середовища на іонний обмін
| 2
|
| [1],[2],
[3],[10]
| | Тема 4. Практичне використання електрокінетич- них явищ
| 2
|
| [1],[2],
[3],[10]
| | Тема 8. Захисна дія ВМС
| 2
|
| [1],[2],
[3],[10]
| | Тема 11. Запобігання забруднення навколишнього середовища
| 2
|
| [1],[2],
[3],[10]
| | ВСЬОГО:
| 11
|
|
| | Домашні розрахункові завдання
| семестр 5
тетраместр 10
|
|
| | Домашнє завдання 1. Іонообмінна адсорбція
| 6
| Захист розрахункового завдання, виконаного самостійно
| [1],[4],
[5],[7]
| | Домашнє завдання 2. Основні положення стійкості теорії ДЛФО
| 6
| Захист розрахункового завдання, виконаного самостійно
| [1],[4],
[5],[7]
| | Індивідуальне розрахунково-графічне завдання 1. Отримання і руйнування дисперсних систем
| 15
| Захист індивідуального розрахунково-графічного завдання, виконаного самостійно
| [1],[4],
[5],[7]
|
ДОМАШНІ РОЗРАХУНКОВІ ЗАВДАННЯ
2.1. Завдання 1. Визначити кількість катіоніту та аніоніту відомої марки, необхідну для знесолення 1 м3 води, що містить домішки неорганічних солей (табл. 2.1). Запишіть рівняння реакцій, які перебігають під час знесолення.
Таблиця 2.1
| №
варіанта
| Іоніти
| ПОЄ,
екв/кг
| Вміст солей у воді, г/л
| | NaСl
| MgCl2
| Na2SO4
| КНСО3
| А12(SO4)3
| | 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| | 1
| К:КУ-2-8 А: ІRА-400
| 4,7
4,4
| -
| 0,03
| 0,04
| 0,12
| 0,005
| | 2
| К: КРS-20 А: АВ-17
| 5,5
3,6
| 0,03
| -
| 0,23
| 0,3
| 0,01
| | 3
| К:S-100 А:АТ-660
| 5,3
4,3
| 0,035
| 0,028
| -
| 0,09
| 0,012
| | 4
| К:ІR-120 А: А-101
| 4,9
4,0
| 0,04
| 0,044
| 0,07
| -
| 0,009
| | 5
| К: Зероліт -225 А: SBW
| 4,5
4,0
| 0,078
| 0,034
| 0,058
| 0,042
| -
| | 6
| К:Варіон КS А: М-500
| 4,7
4,8
| 0,021
| 0,045
| 0,073
| -
| 0,0059
| | 7
| К: КУ-23 А: АВ-29-12П
| 4,8
3,7
| 0,046
| 0,025
| -
| 0,091
| 0,0023
| | 8
| К: КБ-2 А: АН-18П
| 6,0
3,5
| 0,055
| -
| 0,062
| 0,011
| 0,0052
| | 9
| К: КБ-2П А: АН-22-8
| 5,4
5,7
| -
| 0,012
| 0,026
| 0,070
| 0,010
| | 10
| К: КБ-4 А: АН-24
| 4,8
5,4
| 0,035
| -
| 0,031
| 0,17
| 0,0053
| | 11
| К: КУ-2-8 А: АН-22-8
| 4,7
5,7
| 0,044
| 0,051
| -
| 0,17
| 0,0062
| | 12
| К: КРS-20 А: АН-18П
| 5,5
3,5
| 0,042
| 0,057
| 0,15
| -
| 0,0048
| | 13
| К: S-100 А: АН-221
| 5,3
5,4
| 0,047
| 0,086
| 0,12
| 0,095
| -
| | 14
| К: ІR-120 А: АН-18П
| 4,9
3,5
| 0,014
| 0,046
| 0,084
| -
| 0,0087
| | 15
| К: Зероліт -225 А: АВ-29-12П
| 4,5
3,7
| 0,021
| 0,037
| -
| 0,22
| 0,0073
| | 16
| К: Варіон КS А: SBW
| 4,7
4,5
| 0,11
| -
| 0,021
| 0,24
| 0,0047
| | 17
| К: КУ-23 А: М-500
| 4,8
4,8
| -
| 0,0087
| 0,094
| 0,14
| 0,0056
| | 18
| К: КУ-2-8 А: АН-18-8
| 4,7
3,5
| 0,074
| -
| 0,0095
| 0,019
| 0,0025
|
Продовження табл. 2.1
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| | 19
| К: КРS-20 А: АН-21
| 5,5
4,5
| 0,054
| 0,068
| -
| 0,14
| 0,0073
| | 20
| К: S-100 А: АН-22-8
| 5,3
5,5
| 0,046
| 0,047
| 0,042
| -
| 0,0086
| | 21
| К: ІR-120 А: ЕДЕ-10П
| 4,9
8,2
| 0,028
| 0,074
| 0,16
| 0,09
| -
| | 22
| К: КУ-1 А: АН-1
| 4,7
5,0
| 0,017
| 0,063
| 0,064
| -
| 0,057
| | 23
| К: Зероліт -225 А: АН-2ФН
| 4,5
7,4
| 0,037
| 0,074
| -
| 0,056
| 0,10
| | 24
| К: КУ-2-8Г А: АНГ-31
| 3,0
5,0
| 0,057
| -
| 0,073
| 0,015
| 0,0085
| | 25
| К: СГ-1Г А: АВ-17Г
| 6,0
2,8
| -
| 0,12
| 0,053
| 0,11
| 0,010
|
2.1.1. Приклад.Скільки катіоніту та аніоніту знадобиться для знесолення 20 л 1%-го водного розчину А1С13? ПОЄ катіоніту 5,2 мг-екв/г, аніоніту – 3,8 мг-екв/г, густина розчину – 1.
Розв’язання
1. Записуємо рівняння дисоціації солі: А1С13 → А13+ + 3 С1-.
2. Записуємо рівняння іонного обміну:
а) на катіоніті: 3R-Н + А13+ → R3А1 + 3 Н+;
б) на аніоніті: R-ОН + С1- → R-С1 + ОН-.
3. Визначаємо, скільки еквівалентів солі міститься у розчині:
nА1С13= 3g А1С13/М А1С13 = 3ω∙gр ⁄ M А1С13= 3∙1∙20∙10/133,5 = 4,49 екв.
де g А1С13 – маса солі у розчині; М А1С13 – молекулярна маса солі; ω – масовий процент солі у розчині; gр – маса розчину, кг; 3 і 10 – перевідні коефіцієнти, що залежать від заряду іонів та одиниць вимірювання кількості розчину.
4. Знаходимо необхідну кількість іонітів за рівнянням:
g = nА1С13/ПОЄ
а) катіоніту: gк = nА1С13/ПОЄк = 4,49екв/5,2екв/кг = 0,86 кг;
б) аніоніту: gа = nА1С13/ПОЄа = 4,49екв/3,8екв/кг = 1,18 кг.
Примітка: при наявності у розчині не однієї, а декількох солей, необхідно обчислювати загальну кількість еквівалентів електролітів.
2.2. Завдання 2. Використовуючи рівняння теорії ДЛФО визначте сумарну потенціальну енергію взаємодії частинок у водних розчинах 1-1 валентних електролітів. Дані для розрахунків наведені в таблиці 2.2. Радіуси сферичних частинок вимірюються в нанометрах. За отриманими даними побудуйте графік залежності енергії взаємодії від відстані між частинками. Проаналізуйте отриману залежність, поясніть природу екстремумів на кривій.
Таблиця 2.2
| №
варі-анта
| Форма частинки
| Відстань між частинками, нм
| Концен-трація, моль/л
| А·1020,
Дж
| φδ·103,
В
| ε
| Т,К
| | 1
| Пластина
| 5; 10; 20; 40; 80; 100; 150
| 1∙10-4
| 2,0
| 40
| 80,1
| 293
| | 2
| Пластина
| 5; 10; 20; 40; 80; 100; 150
| 4∙10-3
| 3,5
| 30
| 77,8
| 300
| | 3
| Сфера, r=100
| 1; 5; 10; 15; 20; 50
| 5∙10-4
| 11,5
| 40
| 80,1
| 293
| | 4
| Сфера, r=50
| 2; 4; 8; 16; 32; 50
| 1∙10-4
| 0,5
| 50
| 80,1
| 293
| | 5
| Пластина
| 5; 10; 40; 80; 160; 200
| 2∙10-3
| 3,0
| 20
| 77,8
| 300
| | 6
| Пластина
| 3; 6; 12; 24; 50; 70; 100
| 1∙10-3
| 1,25
| 10
| 80,1
| 293
| | 7
| Пластина
| 4; 8; 16; 32; 60; 80; 100
| 8∙10-4
| 5,0
| 20
| 87,8
| 273
| | 8
| Сфера, r=100
| 1; 5; 10; 15; 20; 50
| 5∙10-2
| 1,0
| 40
| 80,1
| 293
| | 9
| Сфера, r=80
| 2; 4; 8; 16; 32; 50
| 3∙10-3
| 0,5
| 20
| 77,8
| 300
| | 10
| Пластина
| 3; 6; 15; 30; 60; 90; 150
| 2,5∙10-3
| 1,7
| 35
| 77,8
| 300
| | 11
| Сфера, r=200
| 5; 10; 20; 30; 40; 50
| 3∙10-3
| 0,56
| 20
| 80,1
| 293
| | 12
| Пластина
| 10; 20;40; 80; 100; 150
| 2∙10-2
| 2,0
| 40
| 87,8
| 273
| | 13
| Пластина
| 5; 10; 20; 40; 60; 100; 150
| 2,5∙10-4
| 3,5
| 40
| 80,1
| 293
| | 14
| Пластина
| 5; 10; 20; 40; 80; 100; 200
| 3∙10-2
| 3,0
| 20
| 77,8
| 300
| | 15
| Сфера, r=150
| 1; 5; 10; 15; 20; 50
| 2∙10-3
| 1,5
| 10
| 77,8
| 300
| | 16
| Сфера, r=60
| 3; 6; 12; 24; 40; 50
| 5∙10-4
| 0,5
| 40
| 80,1
| 293
| | 17
| Пластина
| 1; 5; 10; 15; 20; 50; 100; 150
| 5∙10-3
| 1,25
| 30
| 80,1
| 293
| | 18
| Сфера, r=40
| 5; 10; 20; 30; 40; 50
| 1∙10-3
| 5,0
| 15
| 80,1
| 293
| | 19
| Сфера, r=100
| 1; 5; 10; 15; 20; 50
| 7∙10-4
| 1,5
| 20
| 77,8
| 300
| | 20
| Пластина
| 5; 10; 20; 30; 40; 80; 100
| 2,5∙10-3
| 5,0
| 10
| 87,8
| 273
| | 21
| Сфера, r=200
| 2; 4; 8; 16; 32; 50
| 4∙10-3
| 0,56
| 30
| 77,8
| 300
| | 22
| Пластина
| 4; 8; 16; 32; 60; 100; 150
| 9∙10-4
| 1,7
| 15
| 77,8
| 300
| | 23
| Пластина
| 5; 10; 20; 40; 80; 150; 200
| 3∙10-2
| 2,5
| 40
| 80,1
| 293
| | 24
| Сфера, r=70
| 3; 6; 12; 25; 60
| 2∙10-2
| 5,0
| 30
| 87,8
| 300
| | 25
| Сфера, r=35
| 1; 5; 10; 15; 20
| 5∙10-3
| 0,6
| 2,5
| 87,4
| 313
|
2.2.1. Приклад.Теорія ДЛФО розглядає процес коагуляції як результат сумісної дії вандерваальсових сил притягування та електростатичних сил відштовхування. В залежності від балансу цих сил у тонкому прошарку рідини між частинками, що зближуються, виникає або позитивний „розклинювальний” тиск, який запобігає їх об’єднанню, або негативний, який призводить до виникнення контакту між частинками.
Для області малих електростатичних потенціалів сумарна енергія взаємодії визначається наступним чином:
U = Uе + Uм, (2.1)
де Uе – енергія електростатичного відштовхування частинок;
Uм – енергія притягування.
1) Частинки є плоским тілом (пластини)
Uе = 2 ε0 ε χ φδ2 е –χh , (2.2)
де ε0 = 8,85 · 10-12 Ф·м-1 (електрична стала);
φδ – електричний потенціал дифузного шару, В;
ε – діелектрична проникність дисперсійного середовища;
χ – величина, що є зворотною товщині дифузного шару;
h – відстань між частинками, м.
Для визначення χ використовується рівняння:
 , (2.3) , (2.3)
де R=8,314 Дж/мольК – універсальна газова стала;
T – температура, К;
F=96500 Кл/моль – стала Фарадея;
I – іонна сила розчину, яка дорівнює I=1/2 Σсizi.
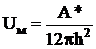 , (2.4) , (2.4)
де А* – стала Гамакера, Дж;
π=3,1416;
h – відстань між частинками, м.
2) Для частинок, які є сферами.
Uе = 2 π ε0 ε r φδ2 (1+е –χh); (2.5)
 . (2.6) . (2.6)
Розрахунки проводяться для всіх наведених значень h, після чого будуються графіки залежностей Uе=f(h), Uм=f(h), U=f(h).
РозрахуНково-графічне завдання за темою
„ОТРИМАННЯ І КОАГУЛЯЦІЯ ЛІОФОБНИХ ЗОЛІВ”
І. При досить повільному введенні розчину речовини В (концентрація СВ, об’єм VВ) у розчин речовини А (концентрація СА, об’єм VА) можливе утворення золю (табл. 3.1).
1) Наведіть рівняння реакції, запишіть формулу міцели.
2) До якого полюсу будуть прямувати частинки золю у полі постійного електричного струму? Чому? Як називається це явище? Які ще з явищ цього типу Вам відомі? Коротко опишіть кожне.
3) Оберіть найбільш економічний коагулятор з ряду запропонованих. Від заряду яких іонів залежить порог коагуляції? Відповідь обгрунтуйте за допомогою відповідного правила.
4) Схематично накресліть подвійний електричний шар, що утвориться на поверхні частинки золю, покажіть і поясніть хід залежності потенціалу від відстані від твердої фази у відсутності коагулятора та при його введенні у систему у різних кількостях.
5) Яким чином можна стабілізувати колоїдну систему? Охарактеризуйте основні стабілізаційні фактори.
6) У якому випадку, при проведенні даної реакції, утворення золю не відбудеться? Яку кількість розчину речовини В з концентрацією СВ для цього необхідно додати до заданого об’єму розчину речовини А?
ІІ. При вивченні кінетики коагуляції отриманого золю обраним коагулятором отримали експериментальні дані, наведені у табл. 3.2.
7) Сформулюйте основні положення теорії швидкої коагуляції Смолуховського, покажіть можливість застосування рівняння Смолуховського до даного процесу.
8) Визначте час половинної коагуляції і константу швидкості коагуляції за експериментальними даними.
9) Обчисліть теоретичні значення цих величин за температури Т і в’язкості 10-3Па та порівняйте з дослідними, зробіть висновок щодо швидкості коагуляції.
10) Розрахуйте і побудуйте залежності загальної кількості частинок, одинарних, подвійних та потрійних частинок від часу, поясніть хід цих залежностей.
Таблиця 3.1
| №
варі-анта
| А
| СА,
моль/л
| VА,
мл
| В
| СВ,
моль/л
| VВ,
мл
| Коагулянт
| | 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| | 1
| Н2SО41
| 0,015
| 50
| ВаС12
| 0,02
| 47
| НС1, К2SО4, FеС13
| | 2
| NаІ
| 0,15
| 1,0
| АgNО3
| 0,095
| 98
| NaF, Ва(NО3)2, К2SО4
| | 3
| МgС12
| 0,02
| 24
| NаОН
| 0,057
| 70
| КС1, Zn(Ас)2, А1С13
| | 4
| NН4СNS
| 0,025
| 80
| АgNО3
| 0,05
| 68
| КNО3,NаАс А1С13
| | 5
| СаС12
| 0,03
| 53
| Н2SО4
| 0,095
| 96
| А1С13 NаАс К2СrО4
|
Продовження табл. 3.1
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| | 6
| ВаС12
| 0,035
| 50
| К2SО4
| 0,067
| 34
| Zn(Ас)2, А1С13 КОН
| | 7
| ВеС12
| 0,04
| 67
| NН4ОН
| 0,08
| 60
| КNО3 ZnС12 Н2SО4
| | 8
| (NН4 )2S
| 0,045
| 95
| АgNО3
| 0,094
| 45
| К2SО4 NаАс К2СrО4
| | 9
| А1С13
| 0,05
| 40
| NаОН
| 0,035
| 73
| К2SО4 КNО3 ZnС12
| | 10
| СrС13
| 0,055
| 36
| КОН
| 0,073
| 20
| К2SО4 КС1 Fе(NО3)2
| | 11
| МnС12
| 0,03
| 78
| NаОН
| 0,04
| 45
| NаАс К2СrО4 Fе(NО3)2
| | 12
| ZnС12
| 0,063
| 50
| К2S
| 0,047
| 62
| КС1 К2СrО4 Fе(NО3)2
| | 13
| МnС12
| 0,089
| 64
| К2S
| 0,098
| 10
| К2SО4 КС1 Fе(NО3)2
| | 14
| FеС13
| 0,034
| 58
| NаОН
| 0,08
| 35
| КNО3 К2СrО4 Fе(NО3)2
| | 15
| К2SО4
| 0,07
| 30
| Ва(NО3)2
| 0,034
| 63
| А1С13 К2СrО4 КОН
| | 16
| СоС13
| 0,064
| 65
| К2S
| 0,075
| 25
| К2SО4 КС1
| | 17
| NiС12
| 0,09
| 84
| Li2S
| 0,04
| 50
| NаАс К2СrО4
| | 18
| SnС12
| 0,059
| 60
| К2S
| 0,038
| 44
| К2SО4 КС1
| | 19
| СdС12
| 0,07
| 85
| Н2S
| 0,053
| 52
| NаАс К2СrО4
| | 20
| АgNО3
| 0,040
| 70
| НС1
| 0,023
| 70
| К2SО4 КОН
| | 21
| АgNО3
| 0,075
| 69
| Н2S
| 0,02
| 41
| К2SО4 NaF ZnС12
| | 22
| FеС13
| 0,06
| 37
| Са(ОН)2
| 0,01
| 12
| А1С13 К2СrО4 КОН
| | 23
| Нg2(NО3)2
| 0,047
| 96
| Н2SО4
| 0,075
| 60
| КNО3 ZnС12 К2СrО4
| | 24
| К2СrО4
| 0,064
| 65
| АgNО3
| 0,03
| 64
| Zn(Ас)2, КNО3
| | 25
| Рb(NО3)2
| 0,068
| 60
| КОН
| 0,05
| 30
| КNО3 NаАс ZnС12
|
Таблиця 3.2
| № варі-анта
| Т,К
| Експериментальні дані
| | 1
| 2
| 3
| | 1
| 293
| τ,с
| 0
| 40
| 60
| 120
| 160
| 200
| 240
| | νΣ·10-14
| 15
| 13,5
| 11,5
| 8,15
| 6,82
| 5,85
| 4,12
| | 2
| 298
| τ,с
| 0
| 40
| 140
| 200
| 280
| 340
| 400
| | νΣ·10-14
| 2,69
| 2,49
| 2,17
| 2,04
| 1,85
| 1,75
| 1,52
| | 3
| 303
| τ,с
| 0
| 60
| 120
| 260
| 360
| 400
| 440
| | νΣ·10-14
| 5,22
| 4,96
| 4,48
| 2,92
| 2,5
| 2,37
| 2,04
| | 4
| 308
| τ,с
| 0
| 50
| 125
| 200
| 300
| 400
| 500
| | νΣ·10-14
| 20,2
| 19,1
| 15,04
| 9,54
| 5,66
| 2,45
| 0,21
| | 5
| 293
| τ,с
| 0
| 25
| 100
| 180
| 240
| 300
| 360
| | νΣ·10-14
| 20,26
| 16,25
| 9,05
| 6,27
| 5,14
| 4,35
| 3,78
| | 6
| 298
| τ,с
| 0
| 60
| 140
| 300
| 360
| 420
| 500
| | νΣ·10-14
| 10,5
| 8,2
| 5,65
| 3,68
| 2,28
| 1,93
| 1,01
| | 7
| 313
| τ,с
| 0,
| 40
| 80
| 120
| 160
| 220
| 300
| | νΣ·10-14
| 15,1
| 11,12
| 8,88
| 7,44
| 6,3
| 5,17
| 4,57
| | 8
| 318
| τ,с
| 0
| 60
| 140
| 200
| 280
| 360
| 410
| | νΣ·10-14
| 5,20
| 4,35
| 3,65
| 3,26
| 2,82
| 2,51
| 2,05
| Продовження табл. 3.2
| 1
| 2
| 3
| | 9
| 293
| τ,с
| 0
| 80
| 160
| 240
| 320
| 400
| 480
| | νΣ·10-14
| 2,72
| 2,35
| 2,12
| 1,95
| 1,79
| 1,65
| 1,43
| | 10
| 298
| τ,с
| 0
| 100
| 160
| 200
| 350
| 380
| 420
| | νΣ·10-14
| 10,5
| 6,44
| 5,3
| 4,75
| 3,56
| 3,16
| 2,98
| | 11
| 323
| τ,с
| 0
| 60
| 120
| 180
| 220
| 300
| 360
| | νΣ·10-14
| 2,69
| 2,44
| 2,24
| 2,07
| 1,99
| 1,89
| 1,81
| | 12
| 328
| τ,с
| 0
| 60
| 100
| 140
| 220
| 320
| 380
| | νΣ·10-14
| 20,1
| 11,54
| 9,02
| 7,40
| 5,46
| 4,12
| 3,68
| | 13
| 293
| τ,с
| 0
| 60
| 100
| 140
| 200
| 300
| 400
| | νΣ·10-14
| 15,0
| 10,0
| 8,11
| 6,82
| 5,49
| 4,17
| 2,96
| | 14
| 333
| τ,с
| 0
| 60
| 100
| 300
| 360
| 460
| 520
| | νΣ·10-14
| 2,7
| 2,54
| 2,28
| 1,58
| 1,41
| 1,22
| 0,94
| | 15
| 298
| τ,с
| 0
| 40
| 160
| 260
| 350
| 450
| 500
| | νΣ·10-14
| 20,2
| 13,47
| 6,82
| 4,81
| 3,88
| 3,16
| 2,78
| | 16
| 293
| τ,с
| 0
| 80
| 120
| 240
| 340
| 400
| 480
| | νΣ·10-14
| 10,5
| 7,0
| 6,0
| 4,25
| 3,24
| 3,04
| 2,71
| | 17
| 338
| τ,с
| 0
| 60
| 240
| 360
| 480
| 600
| 800
| | νΣ·10-14
| 5,22
| 4,35
| 2,83
| 2,30
| 1,95
| 1,68
| 1,15
| | 18
| 343
| τ,с
| 0
| 100
| 140
| 220
| 280
| 320
| 400
| | νΣ·10-14
| 20,3
| 9,02
| 7,45
| 5,48
| 4,59
| 4,18
| 3,20
| | 19
| 293
| τ,с
| 0
| 60
| 120
| 260
| 360
| 400
| 500
| | νΣ·10-14
| 5,23
| 4,18
| 3,84
| 2,92
| 2,50
| 2,37
| 2,11
| | 20
| 348
| τ,с
| 0
| 40
| 80
| 120
| 160
| 200
| 260
| | νΣ·10-14
| 15,0
| 13,5
| 10,2
| 8,15
| 6,82
| 5,85
| 4,53
| | 21
| 298
| τ,с
| 0
| 60
| 120
| 180
| 220
| 300
| 380
| | νΣ·10-14
| 2,7
| 2,44
| 2,24
| 2,07
| 1,99
| 1,82
| 1,65
| | 22
| 313
| τ,с
| 0
| 60
| 140
| 300
| 360
| 420
| 480
| | νΣ·10-14
| 10,5
| 8,2
| 5,65
| 3,68
| 2,28
| 2,03
| 1,88
| | 23
| 293
| τ,с
| 0
| 60
| 120
| 180
| 220
| 300
| 380
| | νΣ·10-14
| 2,69
| 2,45
| 2,23
| 2,09
| 1,97
| 1,83
| 1,64
| | 24
| 328
| τ,с
| 0
| 25
| 100
| 180
| 240
| 300
| 360
| | νΣ·10-14
| 20,30
| 16,25
| 9,07
| 6,27
| 5,14
| 4,35
| 3,57
| | 25
| 298
| τ,с
| 0
| 40
| 80
| 120
| 160
| 200
| 240
| | νΣ·10-14
| 15,0
| 13,5
| 10,2
| 8,15
| 6,2
| 5,85
| 5,45
|
3.1. Пояснення до виконання РГЗ.
До п. 1. За приклад візьмемо реакцію між розведеними розчинами фосфорної кислоти та гідроксиду кальцію:
2Н3РО4 + 3Са(ОН)2 → Са3(РО4)2↓ + 6Н2О.
Оскільки в осад випадає Са3(РО4)2,то саме він буде складати тверду фазу золю. Але структура міцели буде залежати від того, який саме з компонентів реакції буде взятий у надлишку. Тобто можливі дві структури:
а) у надлишку Н3РО4: {[﴾m Са3(РО4)2 ﴿·n РО43-·3(n-х)Н+]3х-·3хН+};
б) у надлишку Са(ОН)2: {[﴾m Са3(РО4)2 ﴿·nСа2+·2(n-х)ОН-]2х+·2хОН-}.
Отже, після написання реакції необхідно визначити, яка з речовин взята у надлишку, і структуру міцели складати відповідно.
До п. 3. Вибір економічного коагулятора здійснюють, керуючись правилами Шульце-Гарді.
До п. 8. Використовують рівняння Смолуховського у лінійній формі:
ν0/νΣ = 1 + τ/θ (ν0 – концентрація частинок у початковий момент часу; νΣ – у довільний момент часу τ; θ – час половинної коагуляції).
Побудова графіка у координатах ν0/νΣ від τ дає пряму лінію, яка відтинає на осі ординат 1 при нульовому значенні часу. Величина θ, таким чином, визначається як котангенс кута нахилу прямої α.
 ν0/νΣ θ = сtgα ν0/νΣ θ = сtgα
θ = сtgα  
α
|


 , (2.3)
, (2.3)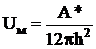 , (2.4)
, (2.4) . (2.6)
. (2.6) ν0/νΣ θ = сtgα
ν0/νΣ θ = сtgα

