Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Температура. Концентрацияпродуктовгидролиза. Концентрациясоли. Разбавление.Типыпротолитическихреакций Реакциянейтрализации– протолитическаяреакцияпереносапро- тонаоткислотыкоснованию, например, HNO3 + KOH = KNO3 + H2O H+ + OH– = H2O Автопротолиз (собственныйпротолиз)– переноспротонамежду двумяодинаковымичастицамиамфолита. Примеры: а) H2O + H2O OH– + H3O+ кис-та 1 осн-е 2 осн-е 1 кис-та 2 Гидролизсолей– протолитическийпроцессвзаимодействияионов солейсмолекуламиводы, приводящийкобразованиюмалодиссоции- рующихсоединений. Гидролизпоаниону– протолитическоевзаимодействиесводойсо- ли, содержащейанион-протолитикатион-непротолит. Примеры: 1) NaClO + H2O HClO + NaOHpH> 7 ClO– + H2O HClO + OH– осн-е 2 кис-та 1 кис-та 2 осн-е 1 АнионявляетсясопряженнымоснованиемслабойкислотыHClO, поэтомувыигрываетконкуренциюуводызапротон, связываяеговсла- буюкислоту. Гидролизпокатиону– протолитическоевзаимодействиесводой соли, содержащейкатион-протолитианион-непротолит. Примеры: Al(OH)3 H2O + H2O [Al(OH)4]– + H3O+ Ka= 3,16 10–8 кис-та 2 осн-е 1 осн-е 2 кис-та 1 Al(OH)3 H2O + H2O Al(OH) 2 2H2O + OH– Kв= 7,41 10–13 осн-е 2 кис-та 1 кис-та 2 осн-е 1 Т.к. Kв<Ka, тоAl(OH)3 проявляетвнесколькобольшейстепеникислот- ныесвойства. б) NH4 + Н2О NH3 + H3O+ кис-та 2 осн-е 1 осн-е 2 кис-та 1 79 Гидролизсолипокатионуианиону– протолитическоевзаимодей- ствиесводойсоли, содержащейкатион-ианион-протолиты. Примеры: а) NH4NO2 + H2O NH3 H2O + HNO2 NH4 + NO2 + H2O NH3 H2O + HNO2 рKа(HNO2) = 3,29; рKв(NH3 H2O) = 4,76. Реакциясредыслабокислая, т.к. рKа(HNO2) <рKв(NH3 H2O). Гидролизбелков, жиров, полисахаридов R1–фосфат + АДФ R1H + АТФ АТФ + R2H R2–фосфат + АДФ Сопряженныекислотно-основныепары, т.е. совокупностькислотыиеесопряженногооснованияилиоснованияиегосопряженнойкислотыназываютпротолитами.  Протолитическоеиликислотно-основноеравновесиеустанавли-ваетсяврезультатеконкуренциизапротон (Н+) междуоснованиямивзаи- модействующихсопряженныхкислотно-основныхпар.
18.Автопротолизводы– этопроцессотдачииприсоединенияпрото-новмолекуламиводы, являющейсяамфолитом: Н2О+Н2ОН3О++ОН–Ионноепроизведениеводы, Kw– величина, равнаяпроизведениюактивностейводород- игидроксид-ионов, постояннаяприданнойтемпе-ратуре: Kw = а(Н+)а(ОН–) = 10–14 моль2/л2 (Т= 298 К) Водородныйпоказатель, рН– количественнаяхарактеристикаки-слотностисреды, равнаяотрицательномудесятичномулогарифмуактив-нойконцентрацииионовводорода: рН = –lgа(Н+)
19.Гидро́лиз — одинизвидовхимическихреакций сольволиза, гдепривзаимодействиивеществс водой происходитразложениеисходноговеществасобразованиемновыхсоединений.
Вживыхорганизмахпроисходитферментативныйгидролизжиров. Вкишечникеподвлияниемферменталипазыжирыпищигидратизуютсянаглицериниорганическиекислоты, которыевсасываютсястенкамикишечника, иворганизмесинтезируютсяновыежиры, свойственныеданномуорганизму. Ониполимфатическойсистемепоступаютвкровь, азатемвжировуюткань. Отсюдажирыпоступаютвдругиеорганыитканиорганизма, гдевпроцессеобменавеществвклеткахопятьгидролиэу-ютсяизатемпостепенноокисляютсядооксидауглеродаиводысвыделеииемэнергии, необходимойдляжизнедеятельности.
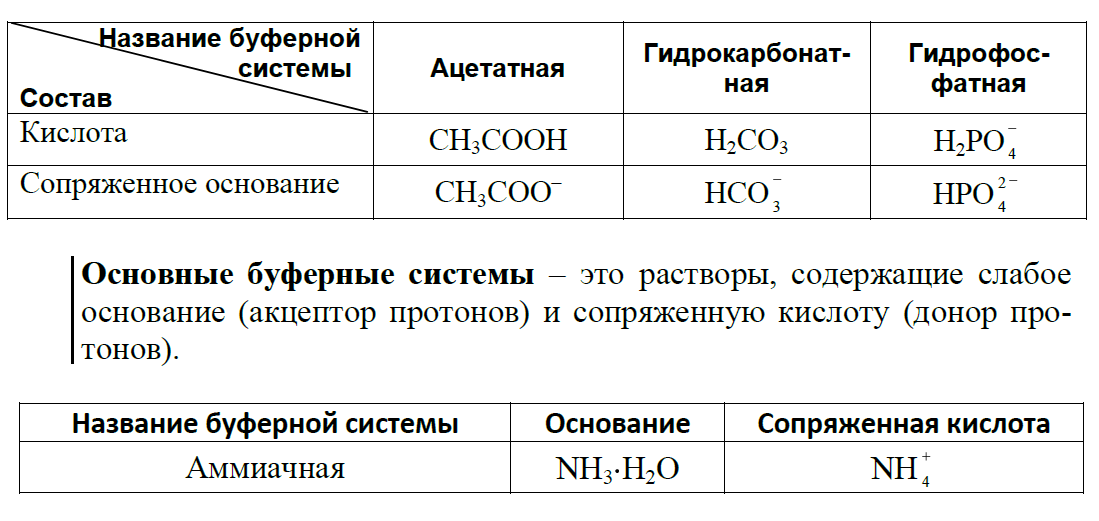
Факторы, влияющиенастепеньгидролиза. Температура. Концентрацияпродуктовгидролиза. Концентрациясоли. Разбавление. (17 вопрос) 20.Буфернаясистема– этораствор, содержащийпротолитическуюравновеснуюсистему, способнуюподдерживатьпрактическипосто-янноезначениерНприразбавленииилипридобавлениинебольшихколичествкислотыилищелочи. Кислотныебуферныесистемы– эторастворы, содержащиеслабуюкислоту (донорпротонов) исопряженноеоснование (акцепторпротонов).
26.Буферная емкость (В)– количество вещества эквивалента кислоты или щелочи, которое нужно добавить к 1 литру буферного раствора, чтобы изменить величину рН на единицу. Буферная емкость зависит от концентраций компонентов в буфер- ном растворе и их соотношения. Чем выше концентрация компонентов, тем большее количество приливаемых кислот и оснований может быть ими связано.
27. 28. Химические гетерогенные процессы включают в качестве этапа химические реакции, которые идут в одной из фаз после перемещения туда реагентов или на поверхности раздела фаз. Гетерогенные равновесия в процессах перехода вещества из одной фазы в другую, не сопровождающиеся изменением химического состава этого вещества, принято называть фазовыми равновесиями.
29.Конкурирующие гетерогенные процессы: конкуренция за катион или анионОсаждение малорастворимых соединений идет дробно. Вначале осаждается наиболее трудно растворимое соединение, константа раство-римости которого достигается при наименьшей концентрации осаждаю- щего реагента, а затем осаждаются другие соединения в порядке возраста- ния их констант растворимости.
30. Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье. При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ. Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия. При проведении в растворе таких реакций, которые могут привести к выделению осадка, существует определенное требование к значению аналитических концентраций реагентов − условие выпадения осадка. Образование осадка малорастворимого сильного электролита МxАy произойдет только тогда, когда после смешивания растворов реагентов в конечном объеме смеси будет соблюдаться соотношение (сMy+)x · (сАx−)y >ПР(MxAy) где в круглых скобках стоят выбранные (по условию проведения опыта) молярные концентрации катионов и анионов в конечном растворе (после смешивания растворов реагентов). Если условие выпадения осадка не выполняется, т.е. (сMy+)x · (сАx−)y <ПР(MxAy ), то образование осадка происходить не будет. |
||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 168. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |