
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Опыт №2. Реакции с образованием газа.а) Наблюдение: ………………………………………………………………………………………………………………………….. ………………………………………………………………………………………………………………………………………………………….. Уравнение реакции Na2CO3 + H2SO4 ® …..................................................................... ............................................................................................................................................................................... ............................................................................................................................................................................... б) Наблюдение: …………………………………………………………………………………………………………………………. ………………………………………………………………………………………………………………………………………………………….. Уравнение реакции CaCO3 + H2SO4 ® …...................................................................... ............................................................................................................................................................................... ............................................................................................................................................................................... Опыт №3. Реакции с образованием слабого электролита. а) Фенолфталеин в растворе щёлочи становится ……………………………………………., т.к. среда ………………………………………… При добавлении серной кислоты окраска ……………………………………………….., потому что …………………………………………………………………………… ………………………………………………………………………………………………………………………………………………………….. Уравнение реакции NaOH + H2SO4 ® ….................................................................................. ................................................................................................................................................................................ ................................................................................................................................................................................ б) Наблюдения……………………………………………………………………………………………………………………………..  ………………………………………………………………………………………………………………………………………………………..… ………………………………………………………………………………………………………………………………………………………..… Уравнение реакции CH3COONa + H2SO4 ® …........................................................................ ................................................................................................................................................................................. ................................................................................................................................................................................. Электролитическая диссоциация - …………………………………………………………………................ …………………………………………………………………………………………………………………………………………………………… · ………………………………………………………………………………………………………………………………………………. ………………………………………………………………………………………………………………………………………………. · Электролиты бывают ......................................................................................................... ................................................................................................................................................................................ · К сильным электролитам относятся ...................................................................... ................................................................................................................................................................................ ................................................................................................................................................................................ · Реакции ионного обмена протекают до конца если образуются ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….. ................................................................................................................................................................................ ................................................................................................................................................................................
Закономерности протекания химических реакций.. Цель: Экспериментально доказать влияние природы реагирующих веществ, температуры, катализатора и величины поверхности раздела реагирующих веществ на скорость химической реакции. Оборудование:: кусочек и порошок мела, цинк, магний, железо, оксид меди (ll), растворы сульфата меди, перекиси водорода, гидроксида аммония и серной кислоты; горячая вода, пробирки, спички, спиртовка, держатель для пробирок. Ход работы: Опыт №1. Влияние природы реагирующих веществ. Рисунок Наблюдения ………………………………………………………………………………. ……………………………………………………………………………… ………………………………………………………………………………. ……………………………………………………………………………… ……………………………………………………………………………… ……………………………………………………………………………… · Более интенсивное выделение водорода происходит в пробирке №......, т.к. ….................................................................................................................................... ................................................................................................................................................................................ · Уравнения реакций Mg + H2SO4 ® ...................................................................... Fe + H2SO4 ® ............................................................................ · Скорость реакции выше в пробирке № ….......... · В проведенном опыте на скорость химической реакции влияет .............................................................................................................................................................................. ............................................................................................................................................................................. · На скорость химической реакции еще влияют следующие факторы ............................................................................................................................................................................... ................................................................................................................................................................................ ............................................................................................................................................................................. · В данном опыте для более интенсивного выделения водорода можно еще применить следующие факторы ..................................................... ............................................................................................................................................................... ................................................................................................................................................................................ ............................................................................................................................................................................... Опыт №2 Влияние катализатора. Рисунок Наблюдения ………………………………………………………………………………. ………………………………………………………………………………. ……………………………………………………………………………… ……………………………………………………………………………… ……………………………………………………………………………… …………………………………………………………………………….. · Бурное протекание реакции наблюдается в пробирке №..........., т. к ……………………………………………………………………………………………………………………………………………….............. · Катализатором в данной реакции служит ......................................................... · Катализатор - это ........................................................................................................... .............................................................................................................................................................................. · Катализ - это ...................................................................................................................... .............................................................................................................................................................................. · Виды катализа: ......................................................................................................................... · В данном случае ................................................. катализ. Опыт №3. Растворение карбоната кальция в серной кислоте. Наблюдения: ............................................................................................................................................ …………………………………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………………………………….. · Уравнение реакции СаСО3 + Н2SO4 ® ...................................................................... · Скорость растворения мела различна, потому что ………………………………… ……………………………………………………………………………………………………………………………………………….. ……………………………………………………………………………………………………………………………………………….. · Данный фактор влияет на скорость ..………………………………………… ..реакций. Опыт №4 Влияние температуры на скорость реакций в гомогенной системе. Рисунок Наблюдения ………………………………………………………………………… ………………………………………………………………………… ………………………………………………………………………… ………………………………………………………………………… ………………………………………………………………………… ………………………………………………………………………… ................................................................................................................................................................................................................................................................................................................................................................. ................................................................................................................................................................................ · ……Уравнение реакции CuO +H2SO4 ® ....................................................................... · Скорость растворения оксида меди (II) в серной кислоте различна, т.к. ..................................................................................................................................................... · Скорости химической реакции зависит от температуры. следующим образом: .............................................................................................................. .............................................................................................................................................................................. · Если температуру повысить на 50 градусов (температурный коэффициент равен 2) скорость химической реакции изменится следующим образом: .............................................................................................................. .............................................................................................................................................................................. ... ............................................................................................................................................................................... Опыт № 5. Влияние концентрации. · Концентрация серной кислоты меньше в пробирке …., т.к. ………………… …………………………………………………………………………………….................................................................... · Наблюдения: ………………………………………………………………………………........................................ ................................................................................................................................................................. · Интенсивность выделения газа в пробирках различна, т.к. ………………………………………………………………………………...................................................................... ................................................................................................................................................................ · Скорость этой реакции зависит от концентрации кислоты следующим образом: …………………………………………………………………….............................. ............................................................................................................................................................ · Уравнение реакции Zn + H2SO4 ® ......................................................................... Вывод ……………………………………………………………………………………………………………………………………….. …………………………………………………………………………………………………………………………………………………………… ................................................................................................................................................................................. ................................................................................................................................................................................. ................................................................................................................................................................................
Окислительно - восстановительные реакции. Цель: Ознакомление с окислительно - восстановительными свойствами металлов, неметаллов и их соединений; освоение методики составления уравнений окислительно - восстановительных реакций. Оборудование: растворы серной кислоты Ход работы: Опыт № 1. Восстановительные свойства металлов. Рисунок: Наблюдения: .................................................................................. .................................................................................. .................................................................................. .................................................................................. .................................................................................. .................................................................................. · Уравнения реакций. ............................................................................................................... ............................................................................................................................................................................ ............................................................................................................................................................................ ............................................................................................................................................................................ ............................................................................................................................................................................ ............................................................................................................................................................................ · Восстановитель - это .................................................................................................... ............................................................................................................................................................................ · Металлы проявляют ....................................................................... свойства. |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 249. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 Электролиты - …………………………………………………………………………………………………………..
Электролиты - ………………………………………………………………………………………………………….. ЛАБОРАТОРНАЯ РАБОТА №4.
ЛАБОРАТОРНАЯ РАБОТА №4. , гидроксида натрия
, гидроксида натрия  ,пероксида водорода
,пероксида водорода 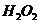 , иодида калия KJ, сульфата меди, кристаллический йод
, иодида калия KJ, сульфата меди, кристаллический йод  , двуокись марганца, оксид меди, магний или цинк, железо, медь; пробирки, спиртовка, держатель, спички, лучинка.
, двуокись марганца, оксид меди, магний или цинк, железо, медь; пробирки, спиртовка, держатель, спички, лучинка.