
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение чистоты эфира с помощью омыления.Лабораторная работа № 2 по дисциплине«Б1.В.ОД.3 Обобщение и анализ существующих химических технологий. Планирование многостадийных синтезов» «Синтез сложных эфиров с последующим омылением» Цель работы –изучение органических веществ, методов проведения реакций, расчет загрузки исходных компонентов, установление чистоты продуктов реакции. Теоретическая часть Реакция этерификация это обратимый процесс взаимодействия органических кислот со спиртами. На количественный выход эфиров, кроме природы реагентов влияет: состояние реагентов в исходной смеси, природа катализатора, температура, температура, интенсивность перемешивания и т.д. Основным фактором, при прочих одинаковых условиях, влияющим на скорость этерификации, является природа углеводородных радикалов кислоты и спирта. Скорость реакции падает при переходе от низших спиртов к высшим, от первичных к третичным. Чем выше кислотные свойства кислоты и спирта, тем легче соединения вступают в реакцию этерификации. Механизм реакции этерификации представлен следующим образом: Общая схема реакции этерификации:
Катализатор – серная кислота, необходима для образования карбкатиона из карбоновой кислоты.
Далее, карбкатион нуклеофильно атакуется кислородом спиртовой группы:
Происходит образование карбкатиона другой структуры, который, далее, теряет протон и молекулу в виде катиона гидроксония:
Все стадии процесса этерификации равновесны, причем сдвига равновесия можно достичь, взяв избыток одного из исходных веществ или, удаляя один из конечных продуктов. Удаляют из реакционной массы наиболее легкокипящий компонент. Время реакции определяется не только достижением равновесия и составом продуктов реакции, но и скоростью течения побочных реакций. При продолжительном пребывании исходных веществ в зоне реакции, выход эфиров уменьшается.  Многие сложные эфиры обладают приятным запахом, поэтому широко используются в парфюмерии. Сложные эфиры жирных кислот и спиртов используются в качестве поверхностно-активных веществ, которые широко применяются в производстве синтетических моющих средств, эмульгаторов и т.д. природные масла и жиры также представляют в своей основе сложные эфиры. Экспериментальная часть. Студенту предлагается выполнить синтез сложного эфира, выдается индивидуальное задание на расчет загрузки исходных веществ с учетом 10 % избытка спирта, студент должен проанализировать физические константы исходных и конечных продуктов синтеза и на основании этого сделать выбор метода синтеза, объема используемой посуды. 2.1. Уравнение основной реакции:
Кислота – уксусная, спирт – (этиловый, изопропиловый, пропиловый, бутиловый, втор.бутиловый, трет.бутиловый, изобутиловый, амиловый, изоамиловый). 2.2. Уравнения побочных реакций:
(2)
1.3 Синтез эфиров с температурой кипения менее 100 0С Схема установки для проведения синтеза изображена на рис.1. Проведение синтеза В колбу Вюрца наливают смесь: 2,5 мл спирта и 2,5 мл концентрированной серной кислоты, а остальное расчетное количество спирта и уксусной кислоты заливают в делительную воронку. При температуре реакционной смеси 100 0С начинают приливать смесь из делительной воронки с такой же скоростью, как идет отгонка эфира. После окончания синтеза, когда вся смесь кислоты и спирта прилита в реакционную колбу, а в колбе осталось 2-2,5 мл жидкости, синтез заканчивают. Отключают нагреватель и разбирают установку. Содержимое приемника переносят в делительную воронку и промывают 30-50 мл раствора углекислого натрия (Na2CO3) для удаления непрореагированной уксусной кислоты и 30-50 мл воды. При промывке смесь в делительной воронке энергично встряхивают для лучшего перемешивания эфира и промывочного раствора, дают расслоиться и нижний промывочный слой удаляют. Эфир переносят в коническую колбу и сушат безводным кристаллическим сернокислым натрием (Na2SO4), для чего в колбу вносят небольшими порциями соль и встряхивают. После просветления эфира, его переносят в колбу для перегонки, предварительно, измерив объем. 2.4. Синтез эфиров с температурой кипения выше 100 0С Схема установки для проведения синтеза изображена на рис.2. Проведение синтеза В колбу заливают расчетное количество спирта, уксусной кислоты и 2 мл серной кислоты. Осторожно перемешивают, вносят «кипелки». Затем собирают и запускают установку. Контроль за реакцией, осуществляют по объему выделившейся воды в ловушке. Количество воды в ловушке должно быть приблизительно равным «расчетному». Обычно синтез заканчивают при прекращении поступления воды в ловушку насадки Дина – Старка. По окончании синтеза замеряют воду в ловушке насадки, содержимое ловушки и реакционной колбы переносят в делительную установку. Далее, добавляют 30-40 мл воды, встряхивают, дают расслоиться, нижний слой, содержащий уксусную и серную кислоты, удаляют. Затем, промывают 30-50 мл раствора углекислого натрия (Na2CO3) и 30-50 мл воды. При промывке смесь в делительной воронке энергично встряхивают для лучшего перемешивания эфира и промывочного раствора, дают расслоиться и нижний промывочный слой удаляют. Эфир переносят в коническую колбу и сушат безводным кристаллическим сернокислым натрием (Na2SO4), для чего в колбу вносят небольшими порциями соль и встряхивают. После просветления эфира, его переносят в колбу для перегонки, предварительно, измеряя объем. Перегонка Схема установки для проведения синтеза изображена на рис.3. Проведение перегонки В колбу Вюрца заливают полученный эфир, добавляют «кипелки», собирают установку и перегоняют эфир. Процесс заканчивают, когда в колбе Вюрца останется 1-1,5 мл вещества. Замеряют полученный объем эфира (вторично) и определяют на рефрактометре показатель преломления эфира(с точностью до четвертого знака). Эфир готов к омылению. Определение чистоты эфира с помощью омыления. Если вычислить, исходя из молекулярной массы эфира количество щелочи, необходимое для омыления 1 г эфира (так называемое «число омыления»), а затем экспериментально определить эту величину, то, сравнивая их, можно судить о чистоте эфира. В основе определения «числа омыления» лежит реакция омыления сложного эфира.
Схема установки Схема установки для проведения синтеза изображена на рис.4. Проведение реакции В колбе помещают количество щелочи взятое в избытке 10 – 20 %,1 мл эфира, собирают установку и проводят омыление. Параллельно проводят холостой опыт без эфира. Через 1 час содержимое охлаждают, смывают 10 мл воды через холодильник летучие вещества и оттитровывают по фенолфталеину (1% спиртовый раствор) 0,5 н. раствором соляной кислоты (НСl). И рассчитывают «число омыления». Определяют чистоту вещества.
Рис. 1. Схема установки для проведения этерификации для получения эфира с температурой кипения ниже 100 0С. 1 – электронагреватель; 2 – колба Вюрца; 3 – термометр; 4 – делительная воронка; 5 – холодильник Либиха; 6 – аллонж; 7 – приемная колба
Рис. 2. Схема установки для проведения этерификации для получения эфира с температурой кипения более 100 0С. 1 – электронагреватель; 2 – колба круглодонная; 3 – ловушка Дина - Старка; 4 – холодильник Либиха
Рис. 3. Схема установки для перегонки 1 – электронагреватель; 2 – Вюрца; 3 – термометр; 4 – холодильник Либиха; 5 – аллонж; 6 – приемная колба
Рис. 4. Схема установки для омыления 1 – электронагреватель; 2 – водяная баня; 3 – колба коническая; 4 – воздушный холодильник Таблица 1 - Справочные данные к лабораторной работе «Синтез сложный эфиров»
Таблица 2 - Варианты синтезов и индивидуальных заданий
Порядок оформления отчета 1.Название работы 2.Цель работы 3.Схема установки (рис.1 или 2, рис.3, рис.4) 4.Описание синтеза (в соответствии с вариантом). 5.Уравнение основной реакции (для своего спирта в соответствии с вариантом, формула (1)). 6.Уравнение побочных реакций (для своего спирта в соответствии с вариантом (2)). 7.Таблица исходных данных в соответствии с вариантом (шапка аналогична, выписываются данные по своему спирту, сложному эфиру, уксусной кислоте, воде (табл.1)). 8.Таблица расчетных данных по варианту (табл.2) (см. ниже). ПРИМЕР ВЫПОЛНЕНИЯ РАСЧЕТНОГО ЗАДАНИЯ(на примере 1 варианта). 1.Исходя из табл.2 оформляем таблицу по варианту:
Определяем недостающие данные (округляем моли до второго знака после запятой; все остальные значения-до первого). Необходимые данные для расчета (табл.1): Уксусная кислота: мол.вес: 60,05; плотность: 1,0492. Бутиловый спирт: мол.вес: 74,12; плотность:0,8098. Уксусно-бутиловый эфир: мол.вес:116,16; плотность:0,8825.11 Вода: мол.вес:18; плотность:1. 1.Исходя из формулы V=m/p, находим объем спирта (у кого задано численное значение другого компонента, по этой формуле находят объем или массу заданного компонента). V= 15,8/0,8098=19,5. 2.Определяем кол-во молей спирта по формуле: МОЛЬ= m\M, т.е.15,8\74,12=0,21. 3.По уравнению реакции все вещества берутся в кол-ве 1 моля, но для того, чтобы сдвинуть равновесие в сторону образования эфира, кол-во спирта берется с избытком 10%, т.е. в кол-ве 1,1 молей Кислота Спирт Эфир Вода 1 1.1 1 1 Исходя из теоретического кол-ва молей, переходим на моли по варианту: 0,21 молей спирта – 1,1 Х молей кислоты – 1 Х = 0,21х1\1,1= 0,19 Следовательно, исходя из данных по теоретич.молям (см.выше) пишем: Кислота Спирт Эфир Вода 0,19 0,21 0,19 0,19 В том случае, если расчет ведется по другому компоненту, например эфиру, расчет ведется аналогично, учитывая 10% избыток спирта. 4.Далее, используя формулы пп.1,2, определяем все остальные продукты: Кислота: 0,19 х 60,05=11,4; 11,4\1,0492=10,9 Эфир: 0,19 х 116,16=22,1; 22,1\0,8825=25,0. Вода: 0,19 х 18 = 3,4; 3,4\1 = 3,4. Заполняем таблицу :
6. Расчет числа омыления (теоретического) Согласно уравнению (3) расчитываем: М г эфира затрачивается 56000 мг щелочи. Следовательно, Ч.О. = где Ч.О – число омыления; М – молекулярный вес эфира, г По окончании омыления и титрования, определяем число омыления по формуле (5):
где - V1 и V2 – количества мл НС1, пошедших на титрование холостой и рабочей проб, соответственно;
К – поправка к титру; V0 – объем эфира , мл; 0,28 – переходный коэффициент. К – поправка к титру рассчитывается в отношении истинной нормальности КОН к теоретической. Вычисляют чистоту вещества, приняв теоретическое число омыления за 100%. По результатам выполнения лабораторной работы составляют итоговую таблицу: Таблица 3. Итоговая таблица результатов работы
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 579. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
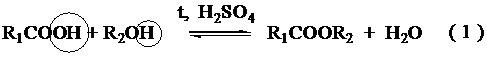





 (3)
(3)



 (4),
(4),
 (5)
(5) - плотность эфира, мг/ см3;
- плотность эфира, мг/ см3;