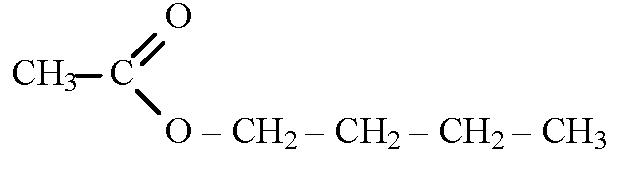Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Физические свойства и нахождение в природеСтр 1 из 3Следующая ⇒ Курсовая работа Тема: «Сложные эфиры»
Выполнил: Ученик 10 физического класса Божедонов Ян Дмитриевич Руководитель: Маленова Любовь Прокопьевна
Г.Якутск,2012 г. Содержание 1.Введение …………………………………………… 3 2.Строение сложных эфиров ………………………...4 3.Номенклатура и изомерия………………………….6 4.Физические свойства………………………………..8 5.Химические свойства ………………………………9 6.Получение…………………………………………..10 7.Применение………………………………………....12 8.Применение в медицине…………………………...13 9.Методика получения сложных эфиров в лабораторных условиях………………………………………….....14 10.Заключение………………………………………15 11.Использованная литература……………………16 Введение Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы. Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой) Например: нитраты производные азотной кислоты, бораты – борной, ацетаты – уксусной, бутираты – масляной . Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.  Цель моей работы заключается в изучении строения, химических свойств сложных эфиров, вопросов их получения и применения отдельных представителей этого класса ДЛЯ ДОСТИЖЕНИЯ ПОСТАВЛЕННОЙ ЦЕЛИ НЕОБХОДИМО РЕШИТЬ СЛЕДУЮЩИЕ ЗАДАЧИ: 1. Литературный анализ химического состава и свойств сложных эфиров 2. Изучение способов получения эфиров 3. Изучение вопроса применения сложных эфиров в медицине и технике 4. Выполнение лабораторной работы по получению сложных эфиров и изучение химических свойств полученных веществ
Строение Строение карбоновых кислот: Общая формула сложных эфиров карбоновых кислот: где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода). Жиры также можно рассматривать как сложные эфиры многоатомного спирта глицерина с карбоновыми кислотами. Общая формула жиров:
где R', R", R"' — углеродные радикалы. Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных. В жирах наиболее часто встречаются следующие жирные кислоты: Алкановые кислоты 1. Масляная кислота СН3 — (CH2)2 — СООН 2. Капроновая кислота СН3 — (CH2)4 — СООН 3. Пальмитиновая кислота СН3 — (CH2)14 — СООН 4. Стеариновая кислота СН3 — (CH2)16 — СООН Алкеновые кислоты 5. Олеиновая кислота С17Н33СООН СН3—(СН2)7—СН === СН—(СН2)7—СООН Алкадиеновые кислоты 6. Линолевая кислота С17Н31СООН СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН Алкатриеновые кислоты 7. Линоленовая кислота С17Н29СООН СН3СН2СН = CHCH2CH == CHCH2CH = СН(СН2)4СООН
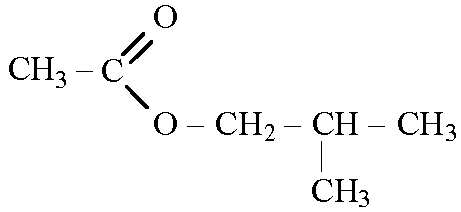
Номенклатура и изомерия Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например: Для сложных эфиров характерны следующие виды изомерии: 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. этилбутират этилизобутират
пропилацетат изопропилацетат 2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
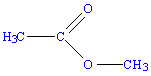
метилпропионат 3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота. метилацетат пропановая кислота Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
Физические свойства и нахождение в природе Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д. Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы. Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров. Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде. Химические свойства 1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза: H+ CH3COOC2H5 + H2O CH3COOH + C2H5OH Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль: R --- COOH + NaOH R --- COONa + H2O 2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. 3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов: [H+] R’---COOR’’ R’---CH2---OH + R’’OH 4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты: R’---CO---OR’’ + NH3 R’---CO---NH2 + R’’OH
Получение 1. Реакция этерификации: Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным. 2. Взаимодействием ангидридов кислот со спиртами:
3. Взаимодействием галоидангидридов кислот со спиртами:
4.Взаимодействие солей кислот с алкилгалогенидами: RCOOMe + RIHal —> RCOORI + MeHal 5.Присоединение карбоновых кислот к алкенам в условии кислотного катализа: RCOOH + RICH=CHRII —> RCOOCHRICH2RII 6.Алкоголиз нитрилов в присутствии кислот: RC(ORI)=N+H2 + H2O —> RCOORI + +NH4 7.Алкилирование карбоновых кислот арилиакилтриазенами: ArN=NNHR + R’COOH —> R’COOR + ArNH2 + N2
Применение Сложные эфиры широко распространены в природе, находят в применение технике, медицине и различных отраслях промышленности. Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты - запах ананасов, изобутиловый эфир уксусной кислоты – запах бананов, изобутилформиат – запах ягод малины, бензилформиат – запах жасмина, фенилэтилформиат – запах хризантем, н-амилацетат – запах груши, н-октилацетат – запах апельсинов и т.д.
Применение в медицине В конце XIX – начала XX века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат в настоящее время практически вытесненный более эффективными средствами. |
||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 286. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |