
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Окислительно-восстановительные реакции (овр). ⇐ ПредыдущаяСтр 2 из 2 Электрохимия опыт 1.Окислительные и восстановительные свойства сернистой кислоты а) Уравнение реакции:H2SO3 + …H2S = ….S↓ + ….H2O Электронные уравнения: ________________________________________________- процесс восстановления; _________________________________________________- процесс окисления.
Окислитель -………..восстановитель -……………….
б) Уравнение реакции: ...Н2SOз + ...I2 + ... Н2O = ... Н2SО4 + ….HI Электронные уравнения: ________________________________________________- процесс восстановления; ________________________________________________- процесс окисления. Окислитель -........................восстановитель -…………….... Sнаходится в группе периодической системы. Высшая степеньокисления ее - ……, низшая -…... Степень окисления S в Н2SО3 - Выводы……………………………………………………………………………. ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
опыт 2.Взаимодействие азотной кислоты с медью
а) Схема взаимодействия концентрированной НNОз с металлами:
HNОз + Ме =>NO2 ↑+ Мe(NO3)п + Н2O
(Здесь и в Опыте 2(б) при составлении уравнений реакций учтите, что НNO3расходуется не только на окисление металла, но и на образование соли Ме(NO3)n)
Элементы теории, примеры зачетных задач Для составления ОВР наиболее простым является метод электронного баланса. В этом методе рассматривается перераспределение электронов между гипотетическими ионами, заряд которых равен соответствующим степеням окисления. Сущность метода электронного баланса состоит в том, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.  Пример 9. ОВР протекает по схеме: Nа2SO3 + К2Сr2O7 + Н2SO4®Nа2SO4 + Сr2(SO4)3 + К2SO4 + Н2O. Укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнении реакции.
Решение В схеме реакции расставим изменяющиеся СО: +4 +6 +6 +3 Nа2SO3 + К2Сr2O7 + Н2SO4®Nа2SO4 + Сr2(SO4)3 + К2SO4 + Н2O. Определим характер процессов: S+4®S+6 - увеличение СО; процесс окисления; Сr+6® Сr+3 - уменьшение СО; процесс восстановления. S+4 (Nа2SO3) - восстановитель, Сr+6(К2Сr2O7) - окислитель. Составляем электронные уравнения: S+4 - 2ē = S+6 - процесс окисления; Сr+6 + Зē = Сr+3 - процесс восстановления. Поскольку число электронов, отдаваемых восстановителем, должно равняться числу электронов, принимаемых окислителем, умножим электронные уравнения на соответствующие коэффициенты: 3| S+4 - 2ē = S+6 2 | Сr+6+3ē = Сr+3 Подставляем эти коэффициенты в схему реакции: 3Nа2SO3 + К2Сr2O7 + Н2SO4®3Nа2SO4 + Сr2(SO4)3 + К2SO4 + Н2O. Находим подбором и расставляем остальные коэффициенты: 3Nа2SO3 + К2Сr2O7 + 4Н2SO4®3Nа2SO4 + Сr2(SO4)3 + К2SO4 + 4Н2O. Окончательная проверка правильности написания уравнения проводится по балансу атомов кислорода: 3•3+7+4•4 = 3•4+4•3+4+4; 32 = 32
Уравнение реакции: ...HNO3(конц) + .... Cu = ……………………………… Электронные уравнения: ________________________________________________- процесс восстановления; ________________________________________________- процесс окисления. Окислитель -........................восстановитель -……………....
б) Схема взаимодействия разбавленной НNО3 с металлами:
НNО3 + Me =>
Уравнение реакции: ...HNO3(разб) + .... Cu = …………………………………… Электронные уравнения: ________________________________________________- процесс восстановления; ________________________________________________- процесс окисления. Окислитель -........................восстановитель -……………....
Выводы: Какой элемент вHNO3является окислителем? Укажите степень его окисления……….
Почему HNO3 проявляет только окислительные свойства?................................................................................................................................
Может ли при восстановлении НNО3 выделяться Н2?
опыт 3.Медно-цинковый гальванический элемент Схема гальванического элемента:
(-)………|…………………..||…………….|…………(+) E0Cu2+/Cu=……B; E0Zn2+/Zn=………B; C (Cu2+) = C(Zn2+) = 1 моль/л Процессы на электродах: (A)……………………………………………. – процесс ………………….. (K)…………………………………………… - процесс …………………… ……………………………………………….. – ионно-молек. уравнение ……………………………………………….. – молекулярное уравнение ЭДС = E(+) – E(-) = ………………………………………………………………..
Элементы теории, примеры зачетных задач Устройства, в которых энергия химической реакции выделяется в виде электрической, называютсягальваническими элементами. Пример 10. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого: Ni | NiSO4|| СuSO4| Сu, если С(Сu2+)=С(Ni2+)=1моль/л Вычислите величину электродвижущей силы (ЭДС). Решение При концентрациях ионов металлов, равных1 моль/л, на металлических электродах устанавливаются стандартные электродные потенциалы: Е°Сu2+/Сu =+0,34В; Е°Ni2+/№=-0,25В На электроде, имеющем меньший потенциал, происходит отдача электронов, т.е. окисление. Этот электрод называется анодом. Поскольку ЕNi2+/Ni< ЕCu2+/Cu> анодом является никелевый электрод. На электроде, имеющем больший потенциал, происходит принятие электронов, т.е. восстановление. Этот электрод называется катодом. Им является медый электрод. Процессы, протекающие в гальваническом элементе: Анод: Ni- 2ē = Ni2+ Катод: Сu2+ + 2ē = Сu ______________________________________________________________________ Ионно-молекулярное уравнение: Ni + Сu2+ = Ni2+ + Сu; Молекулярное уравнение: Ni + СuSO4= NiSO4+Сu. ЭДС=Е(Кат)-Е(Ан) = 0,34 - (-0,25) = 0,59 В. ---------------------------------------------------------------------------------------------------------- Коррозией называется самопроизвольный процесс разрушения металлов и сплавов в результате их окисления окружающей средой. Поскольку коррозия является окислительно-восстановительным процессом, вероятность ее протекания тем больше, чем больше разность потенциалов систем окислителя и восстановителя, Еок-Евосст, т.е. чем больше алгебраическое значение Еоки меньше Евосст- Восстановителем при коррозии является металл. Корродировать в первую очередь будет более активный металл, имеющий меньший потенциал. Окислителем (деполяризатором) в процессе коррозии выступает тот компонент окружающей среды, который имеет больший потенциал.
опыт 4.Защитные свойства металлических покрытий Качественная реакция на ион Fе 2+: 3 Fе2++2[Fе(СN)6]3- = Fе3[Fе(СN)6]2↓ (синий) При коррозии с каким покрытием железа - цинковым или оловянным (луженым) - качественной реакцией открыт ионFе2+? ………………………………………………………………………………………….. а) Оцинкованное железо. Соотношение потенциалов: (Е°Fе2+/Fе =…................... В)……………(Е°Zn2+/Zn =............................................................ ………В), следовательно, анод -........... …….., катод -…………. Процессы: (А)..................... ………………......................... - процесс (К)......................................... ……………….….- процесс ..................................................... ………………………ионно-молек. уравнение ........................................................ …………………..- молекулярное уравнение
б) Луженое железо. Соотношение потенциалов: (Е°Fе2+/Fе =... В)................. (Е°Sn2+/Sn = ……В), следовательно, анод -........... , катод -................. Процессы: (А).................................. ……………............................... - процесс (К)......................................... ……………………………- процесс ........................................................ - ионно-молек. уравнение ........................................................ - молекулярное уравнение Выводы: Какое из покрытий катодное, какое - анодное?..................... Какое покрытие более надежное?......................... Какое покрытие при хорошем качестве более долговечно?.
опыт 5.Электролиз раствора иодида калия
|
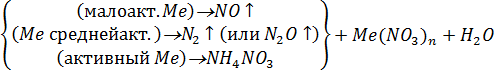

 Е° K+/K= ….B
Е° K+/K= ….B