
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Поэкспериментируем с газами
Если при электролизе использовать достаточно мощный источник тока (например, аккумулятор), то можно получить значительные количества обоих газов и провести с ними простые опыты. В наполненной водородом пробирке осуществим пробу на гремучий газ. Вообще, она дает отрицательный результат, и полученный чистый водород сгорает спокойно. Правда, можно получить и положительную реакцию — если водород смешивается с растворенным в воде пневматической ванны кислородом. Это может произойти при неосторожном насаживании пробирок или, чаще всего, при близком расположении электродов. Кислород легко обнаружить с помощью тлеющей лучины. Зажжем деревянную лучинку, оставим ее некоторое время гореть на воздухе, затем потушим пламя, быстро дунув на него. Тлеющий, обугленный конец лучины введем в пробирку с кислородом. Мы увидим, как тлеющая лучина воспламенится. Будем продолжать исследования до тех пор, пока в пробирках есть газ. С помощью нашего электролизного устройства мы можем также получить чистый гремучий газ и взорвать его. Для этого толстостенный стакан, наполненный водой, поместим одновременно над обоими электродами. Во время электролиза в нем соберется смесь кислорода и водорода. Как только стакан начнет наполняться, осторожно приблизим его, отверстием вниз, к пламени бунзеновской горелки. Последует сильный хлопок и стенки сосуда увлажнятся. Из отдельных элементов в результате реакции соединения мы получили воду. Только проводить этот опыт нужно непременно в защитных очках! Во избежание несчастного случая перед опытом нужно проинструктироваться у знающего специалиста. Кроме того, получать газовую смесь можно только в небольшом количестве, используя в самом крайнем случае стакан вместимостью не более 250 мл. Стакан обмотаем влажной плотной тканью (лучше полотенцем), чтобы не пораниться, если его разорвет. И еще: прежде чем поджигать смесь, в целях предосторожности откроем рот, чтобы защитить барабанные перепонки. Учтите также, что электролитическое получение водорода зачастую сопровождается взрывами. Это гремучий газ самовоспламеняется под действием электрической искры или каталитически действующих примесей. По этой причине можно получать только небольшие количества газа и во время опыта держаться на достаточном расстоянии. 
ВОДА В КРИСТАЛЛАХ
Химикаты считаются особо чистыми, если они представляют собой однородные, достаточно крупные и хорошо сформированные кристаллы. Загрязненные вещества не образуют кристаллов вообще или они получаются мелкие и неправильной формы. Конечно, это не означает, что каждое некристаллическое вещество загрязнено. А как раз самые большие и прекрасные кристаллы часто содержат кристаллизационную воду, которая связана в кристалле и может быть удалена только с большом трудом; при этом кристаллы разрушаются. Кристаллизационную воду химики не относят к загрязнениям химического соединения. Во всех опытах, однако, если мы хотим получить количественно правильные результаты, нужно учитывать наличие кристаллизационной воды в твердых веществах. Например, голубые кристаллы медного купороса [сульфата меди (II)] содержат до 30 % воды, а так называемая кальцинированная сода (карбонат натрия) — даже 60 %. Следовательно: в 100 г кристаллического сульфата меди содержится только 64 г безводной соли, а покупая 1 кг кальцинированной соды, мы приобретаем воды в два раза больше, чем соды. Обнаруживаем кристаллизационную воду Внесем в термостойкую хорошо высушенную пробирку какую-нибудь соль (на кончике ножа) и нагреем ее сначала слабо, а затем сильнее на пламени бунзеновской горелки. Возьмем, например, сульфат меди, карбонат натрия, хлорид магния, хлорид натрия (поваренную соль) и другие соли. В большинстве случаев кристаллы растрескаются, а в верхней холодной части пробирки появятся капельки воды. Из указанных солей только чистая поваренная соль не содержит кристаллизационной воды. После нагревания сульфата меди остается белый осадок безводной соли, голубая окраска полностью исчезает с уходом кристаллизационной воды. Соли кобальта, присоединяя кристаллизационную воду, меняют цвет с голубого на красный. Можем проделать это с несколькими кристалликами хлорида кобальта (II) — вначале нагреть соль в пробирке, а затем поместить ее во влажный воздух. Адсорбированная вода В молекуле воды связи, идущие от центра атома кислорода к обоим атомам водорода, образуют угол Как известно, атомы в соединениях склонны к образованию заполненных электронных оболочек. В нашем случае (с водой) это означает, что оба электрона связи водорода притянуты к кислороду, который более электроотрицателен. Но речь здесь идет не о полной ионизации, а о смещении центра тяжести заряда, когда образуется соединение частично ионного характера. В результате молекулы воды приобретают свойства электрического диполя с отрицательным концом на атоме кислорода, а положительным — на атомах водорода. Эта особенность имеет огромное практическое значение, так как многие по сравнению с другими жидкостями необычные свойства воды обусловлены природой диполя. Так, молекулы воды легко образуют тетраэдрическую структуру. Это упорядочение, которое усиливается ниже 4° С, объясняет, почему вода обладает минимальной плотностью при 4° С, а пористость молекулярной структуры льда примерно на 10 % больше, чем у жидкой воды. Большое внешнее давление не препятствует увеличению объема при замерзании — в этом с досадой убеждаются шоферы, поглядев на размороженный мотор или радиатор. Воспроизведем этот процесс: пузырек из-под лекарства до краев наполним водой, плотно закроем завинчивающейся крышкой и поставим на мороз или в морозильник. Соединение молекул воды можно представить себе как притяжение разноименно заряженных концов диполей. Атомы водорода соединены с двумя намного большими атомами кислорода специфической связью ионного характера, которую называют мостиковой водородной связью. Вследствие своего дипольного характера молекулы воды в особенной степени обладают способностью к адсорбции (присоединению) на поверхностях раздела. Большинство твердых веществ во влажном воздухе покрыто только мономолекулярным адсорбционным слоем воды. На стеклах благодаря присоединению молекул воды силикатами щелочных металлов образуются поверхностные пленки, в которых вода довольно прочно связана. Давайте убедимся в этом. В круглодонную колбу положим несколько кристалликов обезвоженного хлорида кобальта (II) и закроем колбу куском ваты. При нагревании на проволочной сетке в пламени бунзеновской горелки до температуры свыше 150 0С выделится значительное количество адсорбированной воды, которая при охлаждении частично поглотится хлоридом кобальта (II) и изменит его цвет с голубого на красный. Эффект проявится еще более отчетливо, если мы поместим в колбу немного толченого стекла или стеклянной ваты. При дальнейшем нагревании до температуры свыше 300 °С из стекла вновь выделяется вода, поэтому стеклянные части высоковакуумной аппаратуры отжигают до температуры размягчения.
ВОЗДУХ - НЕИСЧЕРПАЕМОЕ СЫРЬЕ
Сегодня мы очень хорошо знаем земную атмосферу, толщина которой составляет более 1000 км. Воздушные шары с людьми и без них, самолеты и ракеты поднялись на большую высоту воздушного пространства и определили количественное содержание бактерий, давление, плотность и состав воздуха. А искусственные спутники Земли посылают на землю точные результаты измерений. Тот, у кого есть глобус диаметром 35 см, может представить себе вокруг него двухсантиметровый слой, и получит, таким образом, представление о величине атмосферы. Атмосфера нашей планеты весит 5,1*1013 меганьютонов, а объем ее составляет более, чем 4*1018 м3. В воздухе содержатся величайшие ценности. Физики и химики размышляют над проблемой их использования. Линде, например, технически реализовал теоретические работы Андрюса, Фарадея, Джоуля и Томсона и развил методы сжижения воздуха. Жидкий воздух является важнейшим источником для получения кислорода, азота и инертных газов. Габер и Бош разработали метод, с помощью которого азот воздуха можно связать с водородом. То, что еще в прошлом столетии казалось утопией, например получение удобрений, кислот и других химических соединений из воздуха, в последние шестьдесят лет стало реальностью.
ИНТЕРЕСНАЯ СМЕСЬ
До конца XVIII века считали, что воздух состоит из одного простого вещества. Только Пристли и Лавуазье, благодаря исследованию процессов сгорания, пришли к выводу, что воздух представляет собой смесь двух элементов. Более, чем через сто лет Рэлей и Рамзай открыли в воздухе другие элементы — инертные газы. Сухой воздух имеет следующий состав (по объему): Азот 78,095 % Кислород 20,939 % Диоксид углерода 0,031 % Инертные газы 0,935 % из них аргон 0,933 % На остальные инертные газы приходится 0,002 %. В 1 м3 воздуха содержится 15 мл неона, 5 мл гелия, 1,1 мл криптона и 0,08 мл ксенона. Гелий до сих пор получали из природного газа. Этот негорючий газ в большом количестве расходовали на заполнение аэростатов и воздушных шаров. Смесью кислорода и гелия дышат водолазы при работе на большой глубине. Ее применяют также для лечения больных астмой. Другие инертные газы получают при многократном ступенчатом испарении жидкого воздуха. Неоном, например, заполняют лампы дневного света и светящиеся трубки реклам, при пропускании электрического тока он излучает интенсивный оранжевый свет. Инертные газы для заполнения люминесцентных и специальных ламп с металлической нитью (например, криптоновых) получаются в качестве ценных побочных продуктов на всех больших предприятиях, которые производят технические газы с помощью сжижения воздуха. В защитной атмосфере аргона проводят сварку, к месту работ его доставляют в баллонах под давлением.
ЭКСПЕРИМЕНТЫ С КИСЛОРОДОМ
Кислород — самый распространенный элемент. Наша атмосфера, как вы уже знаете, содержит 21 % (об.) кислорода: исследованные 16 км земной коры — литосфера — состоит наполовину из кислорода, а водный бассейн — гидросфера — на 89 % (по массе). Растения, животные и человек нуждаются в кислороде, так как от него зависит нормальное протекание жизненных процессов. В промышленности и технике он используется для окисления. Он содержится во многих химических соединениях. Чтобы получить чистый кислород, нужны исходные вещества, богатые этим элементом. К ним относятся нитраты и хлораты, то есть соли азотной и хлорноватой кислоты, а также пероксиды. В технике, где счет идет на тысячи тонн, используются широко распространенные сырьевые источники — воздух и вода. Необходимая для этого аппаратура очень сложна и дорога. В лабораториях, напротив, другие условия, так как в наших опытах часто имеем дело с объемами газов меньше миллилитра. Поэтому аппаратура в лаборатории должна быть дешевой и простои в обращении. Для небольших количеств, которые мы получаем, не имеет существенного значения высокая цена исходных продуктов.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 321. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
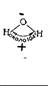 около 104°.
около 104°.