
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Стандартная энергия Гиббса образования некоторых веществКонтрольные вопросы 1. Определите эквивалент и мольную массу эквивалента фосфора, кислорода и брома в соединениях РН3, H2O, HBr. 2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН? Ответ: 100 г. 3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите мольную массу эквивалента этого металла. Ответ: 32, 5 г/моль. 4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите мольную массу эквивалента этого металла. Ответ: 9 г/моль. 5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. 6. Чему равен при н.у. мольный объем эквивалента водорода? Вычислите мольную массу эквивалента металла, если на восстановление 1,017г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32, 68 г/моль. 7. Выразите в молях: а) 6,02 × 1022 молекул С2Н2; б) 1,80 × 1024 атомов азота; в) 3,01 × 10 молекул NH3. Какова мольная масса указанных веществ? 8. Вычислите эквивалент и мольную массу эквивалента Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. 9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите мольные массы эквивалентов металла и его оксида. Чему равна мольная и атомная масса этого металла? 10. Чему равен при н.у. мольный объем эквивалента кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите мольную массу эквивалента, мольную массу и атомную массу этого металла. 11. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите мольную массу эквивалента этого металла. Ответ: 103,6 г/моль. 12. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксoжелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и мольную массу эквивалента Fe(OH)3 в каждой из этих реакций.  13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществе КОН и определите их эквиваленты и мольные массы эквивалентов. 14. В каком количестве Сг(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Ответ. 208,2 г. 15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и мольные массы эквивалентов. 16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите мольные массы эквивалентов металла и его оксида. Чему равны мольная и атомная массы металла? 17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите мольную массу эквивалента, мольную и атомную массы металла. 18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Ответ: 2,0 × 10-23 г, 3,0 × 10-23 г. 19. На нейтрализацию 9,797 г ортофоcфорной кислоты израсходовано 7,998 г NaOH. Вычислите эквивалент, мольную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 49 г/моль, 2. 20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 41 г/моль, 2. Тема 2. Строение атома Контрольные вопросы 21. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 22. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 23. Какое максимальное число электронов могут занимать s-, p-, d-и f-орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31. 24. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов? 25. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Напишите электронную формулу атома элемента с порядковым номером 21. 26. Изотоп никеля – 57 образуется при бомбардировке a– частицами ядер атомов железа– 54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 27. Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 5р? Почему? Напишите электронную формулу атома элемента с порядковым номером 43. 28. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы? 29. Изотоп кремния– 30 образуется при бомбардировке a– частицами ядер атомов алюминия– 27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 30. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей у атомов последнего элемента? 31. Изотоп углерода – 11 образуется при бомбардировке протонами ядер атомов азота – 14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 32. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента? 33. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d-орбиталей в атомах этих элементов? 34. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l = 0, 1, 2 и 3? Какие элементы в периодической системе называют s-, р-, d- и f-элементами? Приведите примеры. 35. Какие значения могут принимать квантовые числа n, l, ml и mS, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния? 36. Какие из электронных формул, отражающих строение не возбужденного атома некоторого элемента, неверны: a) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22p63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы? 37. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит "провал" одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и р-электронов у атомов второго элементов? 38. Квантовые числа для электронов внешнего энергетического, уровня атомов некоторого элемента имеют следующие значения: n =4; l = 0; ml =0; mS = ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей он содержит. 39. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны. 40. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит "провал" одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из этих элементов? Т е м а 3. Энергетика химических процессов (термохимические расчеты) Стандартные теплоты (энтальпии) образования ΔHx.p. некоторых веществ
Контрольные вопросы 41. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж. 42. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: - 45,76 кДж. 43. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO(к) + СО(г) = Fe(к) + СО2(г) ; ΔН = -13,18 кДж. СО(г) + 1/2 О2(г) = СО2(г) ; ΔН = -283,0 кДж. Н2(г) + 1/2О2(г) = Н2О(г); ΔН = -241,83 кДж. Ответ: +27,99 кДж. 44. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. 45. Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж. 46. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений: 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(ж); ΔН=-1168,80 кДж. 4NH3(г) + 3О2(г) = 2N2(г) + 6Н2О(ж) ; ΔН=1530,28 кДж. Ответ: 90,37 кДж.. 47. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж. 48. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений: Н2(г) + 1/2O2(г) = Н2О(ж) ; ΔН = -285,84 кДж. С(к) + О2(г) = СО2(г) ; ΔН =-393,51 кДж. СН4(г) + 2О2(г) =2Н2О(ж) + СО2(г); ΔН = -890,31 кДж. Ответ: -74,88 кДж. 49. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений: Са(к) + 1/2 О2(г) = СаО(к); ΔН = -635,60 кДж. Н2(г) + 1/2О2(г) = Н2О(ж); ΔН = -285,84 кДж. СаО(к) + Н2О(ж) = Са(ОН)2(к); ΔН = -65,06 кДж. Ответ: -986,50 кДж. 50. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6(ж). Ответ: +49,03 кДж. 51. Вычислите, сколько теплоты выделится при сгорании 165л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 9248,8 кДж. 52. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж. 53. Реакция горения метилового спирта выражается термохимическим уравнением CH3OH(ж) + 3/2 О2(г) = СО2(г) + 2Н2О(ж); ΔН = ? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования СН3ОН(ж) равна +37,4 кДж. Ответ: - 726,62 кДж. 54. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: - 277,67 кДж/моль. 55. Реакция горения бензола выражается термохимическим С6Н6(ж) + 7 1/2О2(г) = 6СО2(г) + 3Н2О(г); ΔН = ? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж. Ответ: - 3135,58 кДж. 56. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж. 57. Реакция горения аммиака выражается термохимическим 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔН = 1530,28 кДж. Вычислите теплоту образования NH3(г). Ответ: - 46,19 кДж/моль. 58. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Ответ: - 100,26 кДж/моль. 59. При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2Н2(г). Ответ: 226,75 кДж/моль. 60. При получении эквивалентной массы гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: - 635,6 кДж.
Тема 4. Химическое сродство Стандартная энергия Гиббса образования некоторых веществ
Стандартные абсолютные энтропии
Контрольные вопросы 61. Вычислите а) 2NaF(к) + С12(г) = 2NaCl(к) + F2(г) б) РbО2(к) + 2Zn(к) = Рb(к) + 2ZnО(к) Можно ли получить фтор по реакции (а) и восстановить РbО2 цинком по реакции (б)? Ответ: + 313,94 кДж; -417,4 кДж. 62. При какой температуре наступит равновесие системы 4НС1(г) + О2(г) ↔ 2Н2О(г) + 2Сl2(г); ΔH = -114,42 кДж? Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 К. 63. Восстановление Fe3O4 оксидом углерода идет по уравнению Fe3O4(к) + CO(г) = 3FeO(к) + СО2(г). Вычислите Ответ: +24,19 кДж; +31,34 Дж/(моль·К). 64. Реакция горения ацетилена идет по уравнению С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж) Вычислите 65. Уменьшается или увеличивается энтропия при переходах: Ответ: а) 118,78 Дж/(моль·К); б) -3,25 Дж/(моль·К). 66. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2(г) + СО2(г) = СО(г) + Н2О(ж); ΔН = -2,85кДж? Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите Ответ: +19,91 кДж. 67. Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г) + О2(г) ↔ 2NО2(г) Ответ мотивируйте, вычислив Ответ: -69,70 кДж. 68. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите NH3(г) + HCl(г) = NH4Cl(к) Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92,08 кДж. 69. При какой температуре наступит равновесие системы СО(г) + 2Н2(г) ↔ СН3ОН(ж); ΔН = -128,05 кДж? Ответ: ≈ 385,5 К. 70. При какой температуре наступит равновесие системы СН4(г) + СО2(г)= 2СО(г) + 2Н2(г); ΔН = +247,37 кДж? Ответ: ≈ 961,9 К. 71. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 4NН3(г) + 5O2(г) = 4NO(г) + 6Н2О(г). Возможна ли эта реакция при стандартных условиях? Ответ: - 957,77 кДж. 72. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж) Возможна ли эта реакция при стандартных условиях? Ответ: - 130,89 кДж. 73. Вычислите Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г) Возможна ли реакция восстановления Fе2О3 водородом при температурах 500 и 2000 К? Ответ: + 96,61 кДж; 138,83 Дж/К; 27,2 кДж; – 181,05 кДж. 74. Какие из карбонатов: ВеСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив Ответ: + 31,24 кДж; - 130,17 кДж; – 216,02 кДж. 75. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите СО(г) + 3Н2(г) = СН4(г) + Н2О(г) Возможна ли эта реакция при стандартных условиях? Ответ: - 142,16 кДж. 76. Вычислите ТiO2(к) + 2С(к) = Тi(к) + 2СО(г) Возможна ли реакция восстановления ТiO2 углеродом при температурах 1000 и 3000 К? Ответ: + 722,86 кДж; 364,84 Дж/К; + 358,02 кДж; - 371,66 кДж. 77. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите Возможна ли эта реакция при стандартных условиях? Ответ: - 1331,21 кДж. 78. Определите, при какой температуре начнется реакция восстановления Fе3О4, протекающая по уравнению Fe3O4(к) + СО(г) = 3FeO(к) + СО2(г); ΔН = + 34,55 кДж. Ответ: 1102,4 К. 79. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению РСl5(г) = РС13(г) + С12(г); ΔН = + 92,59 кДж. Ответ: 509 К. 80. Вычислите изменение энтропии для реакций, протекающих по уравнениям: 2СН4(г) = С2Н2(г) + 3Н2(г); N2(г) + 3H2(г) = 2NH3(г) ; С(графит) + О2(г) = СО2(г). Почему в этих реакциях Ответ: 220,21 Дж/К; - 198,26 Дж/К; 2,93 Дж/К. Тема 5. Химическая кинетика и равновесие Контрольные вопросы 81. Окисление серы и ее диоксида протекает по уравнениям: а) S(к) + О2 = SO2(к); б) 2SO2(г) + O2 = 2SO3(г). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза? 82. Напишите выражение для константы равновесия гомогенной системы N2 + 3Н2 ↔ 2NН3. Как изменится скорость прямой реакции - образования аммиака, если увеличить концентрацию водорода в три раза? 83. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л. Ответ: [N2] = 0,0465 моль/л; [О2] = 0,0075 моль/л. 84. Реакция идет по уравнению N2 + 3H2 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л; [Н2] = 1,5 моль/л; [NН3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л. 85. Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2] = 0,03 моль/л. 86. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 800С. Температурный коэффициент скорости реакции 3. 87. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 600С, если температурный коэффициент скорости данной реакции 2? 88. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО. Ответ: K = 20; [Сl2]ИСХ= 1,5 моль/л; [СО]ИСХ= 1,4 моль/л. 89. В гомогенной системе А + 2В ↔ С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 2,5; [А]ИСХ= 0,276 моль/л; [В]ИСХ=0,552 моль/л. 90. В гомогенной газовой системе А + В ↔ С + D равновесие установилось при концентрациях: [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]ИСХ= 0,22 моль/л; [В]ИСХ= 0,07 моль/л. 91. Константа скорости реакции разложения N2О, протекающей по уравнению 2N2O = 2N2 + О2, равна 5·10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, к моменту разложения 50% N2O. Ответ: 1,8·10-2; 4,5·10-3. 92. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции - образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО? 93. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции - образования водяных паров? 94. Равновесие гомогенной системы 4HCl(г) + O2 ↔ 2Н2О(г) + 2С12 (г) установилось при следующих концентрациях реагирующих веществ: [Н2О]P= = 0,14 моль/л; [С12]P = 0,14 моль/л; [НСl]P = 0,20 моль/л; [О2]P = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НСl]ИСХ =0,48 ,моль/л; [О2]ИСХ = 0,39 моль/л. 95. Вычислите константу равновесия для гомогенной системы СО(г) + Н2О(г) ↔ CО2(г) + Н2(г) если равновесные концентрации реагирующих веществ: [СО]Р= 0,004 моль/л; [Н2О]Р = 0,064 моль/л; [СО2]Р = 0,016 моль/л; [Н2]Р = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; [Н2О]ИСХ =0,08 моль/л; [СО]ИСХ = 0,02 моль/л. 96. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2 + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]ИСХ = 0,10 моль/л; [Н2О]ИСХ = 0,40 моль/л. Ответ: [СО2]Р = [Н2]Р = 0,08 моль/л; [СО]Р = 0,02 моль/л; [Н2О]Р = 0,32 моль/л. 97. Константа равновесия гомогенной системы N2 + 3Н2 ↔ 2NН3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: [N2]P = 8 моль/л;[N2]ИСХ =8,04 моль/л. 98. При некоторой температуре равновесие гомогенной системы 2NO + О2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]Р = 0,2 моль/л; [О2]Р = 0,1 моль/л; [NO2]Р = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2. Ответ: К = 2,5; [NО]ИСХ = 0,3 моль/л; [О2]ИСХ = 0,15 моль/л. 99. Почему при изменении давления смещается равновесие системы N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем. 100. Исходные концентрации [NО]ИСХ и [Сl2]ИСХ в гомогенной системе 2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416. Тема 6. Способы выражения концентрации раствора Контрольные вопросы 101. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н. 102. Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Ответ: 9,96 н.; 6,3%. 103. К 3 л 10%-ного раствора HNO3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора, объем которого равен 8 л. Ответ: 5,0%; 0,82 М. 104. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17 м; 931,8 г. 105. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ: 1,38 М; 4,14 н.; 1,43 м. 106. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2SO4 прибавить 125 см3 0,2 н. раствора КОН? Ответ: 0,14 г КОН. 107. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок? Ответ: 0,1 н.; 1,433 г. 108. Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1л 10,17%-ного раствора (пл. 1,050 г/см3)? Ответ: 485,38 см3. 109. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Ответ: 28,38%. 110. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Ответ: 245,5 см3. 111. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3)? Ответ: 923,1 см3. 112. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4? Ответ: 0,023 н.; 1,127·10-3 г/см3. 113. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3. 114. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,53 н. 115. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г, 0,016 г/см3. 116. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г. 117. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%. 118. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Ответ: 45,72%. 119. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%. 120. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%. Тема 7. Свойства растворов Контрольные вопросы 121. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,2960 С. Температура кристаллизации бензола 5,50 С. Криоскопическая константа 5,10. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль. 122. Вычислите процентную концентрацию водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора -0,930 С. Криоскопическая константа воды 1,860. Ответ: 14,6%. 123. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,860. Ответ: -1,030 С. 124. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,7140 С. Температура кипения бензола 80,20 С. Вычислите эбуллиоскопическую константу бензола. Ответ: 2,570. 125. Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,390 С. Эбуллиоскопическая константа воды 0,520. Ответ: 6,45%. 126. Вычислите мольную (молярную) массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,2790 С. Криоскопическая константа воды. 1,860. Ответ: 60 г/моль. 127. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,20 С. Эбуллиоскопическая константа его 2,570. Ответ: 81,25° С. 128. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,4650 С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,860 . Ответ: 342 г/моль. 129. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,7180 С. Температура кристаллизации уксусной кислоты 16,650 С. Ответ: 3,90. 130. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,810С. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,570. Ответ: 8. 131. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна – 0,5580 С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,860. Ответ: 442 г/моль. 132. Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,530. Эбуллиоскопическая константа этилового эфира 2,120. Ответ: 1,16 г. 133. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,860. Ответ: -0,820 С. 134. Сколько граммов мочевины (NН2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650? Криоскопическая константа воды 1,86°. Ответ: 1,12 г. 135. Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,260 С. Эбуллиоскопическая константа воды 0,520. Ответ: 8,25%. 136. Сколько граммов фенола C6H5OH следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,70? Криоскопическая константа бензола 5,10. Ответ: 3,91 г. 137. Сколько граммов мочевины (NН2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,260? Эбуллиоскопическая константа воды 0,520С. Ответ: 7,5 г. 138. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,3720. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,860С. Ответ: 92 г/моль. 139. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,520. Ответ: 101,520 С. 140. Вычислите процентную концентрацию водного раствора метанола CH3OH, температура кристаллизации которого -2,790 С. Криоскопическая константа воды 1,860. Ответ: 4,58%. Тема 8. Ионно-молекулярные (ионные) реакции обмена Контрольные вопросы 141. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) NaHCO3 и NaOH; б) K2SiO3 и НСl; в) BaCl2 и Na2SO4. 142. Составьте молекулярные и ионно-молекуляpные уравнения реакций взаимодействия в растворах между: a) K2S и HCl; б) FeSO4 и (NH4)2S; в) Сr(ОН)3 и КОН. 143. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Мg2+ + СO32- = МgСO3; б) H+ + OH- = H2O. 144. Какое из веществ: Al(OH)3; H2SO4; Bа(ОН)2 - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. 145. Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) СаС12 и AgNO3. 146. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) CuSO4 и H2S; б) ВаСО3 и HNO3; в) FeCl3 и КОН. 147. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Сu2+ + S2- = CuS; б) SiO32- + 2Н+ = H2SiO3. 148. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) Sn(OH)2 и HCl; б) BeSO4 и КОН; в) NH4Cl и Ва(ОН)2. 149. Какое из веществ: КНСО3, СН3СООН, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. 150. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) AgNO3 и К2СгО4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S. 151. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2; б) А1(ОН)3 + ОН- = АlO2- + 2Н2O; в) Рb2+ + 2I- = РbI2. 152. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Сu(ОН)2 и HNO3; в) ZnOHNO3 и HNO3. 153. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH. 154. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: Fe(OH)3 + 3H+ = Fe3+ + 3H2O; Cd2+ + 2OH- = Cd(OH)2; H+ + NO2- = HNO2. 155. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2. 156. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+; б) HCO3- + H+ = H2O + CO2; в) Ag+ + Cl- = AgCl. 157. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba(OH)2; б) FeCl3 и NH4OH; в) CH3COONa и HCl. 158. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и KOH; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3. 159. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be(OH)2 + 2OH- = BeO22- + 2H2O; б) CH3COO- + H+ = CH3COOH; в) Ba2+ + SO42- = BaSO4. 160. Какое из веществ: NaCl, NiSO4, Be(OH)2, KHCO3 – взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций. Тема 9. Окислительно-восстановительные реакции Контрольные вопросы 161. Исходя из степени окисления хлора в соединениях HCl, НС1О3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме КВr + КВrO3 + H2SO4 → Br2 + K2SO4 + Н2О. 162. Реакции выражаются схемами: Р + НIO3 + Н2О → Н3РО4 + HI; H2S + Cl2 + Н2О → H2SO4 + HCl. Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 163. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: As3- → As5+; N3+ → N3-; S2- → S0. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + КОН. 164. Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме PbS + HNO3 → S + Pb(NO3)2 + NO + H2O. 165. См. условие задачи 162. Р + HNO3 + Н2О → Н3РО4 + NО; KMnO4 + Na2SO3 + КОН → K2MnO4 + Na2SO4 + Н2О. 166. Составьте электронные уравнения и укажите, какой процесс - окисление или восстановление – происходит при следующих превращениях: Мn6+ → Mn2+; Cl5+ → Cl-; N3- → N5+. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Cu2O + HNO3 → Cu(NO3)2 + NO + Н2О. 167. См. условие задачи 162. HNO3 + Ca → NH4NO3 + Ca(NO3)2 + Н2О; K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O. 168. Исходя из степени окисления хрома, иода и серы в соединениях К2Сr2О7, KI и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме NaCrO2 + РbО2 + NaOH → Na2CrO4 + Na2PbO2 + Н2О. 169. См. условие задачи 162. H2S + Сl2 + Н2О → H2SO4 + HCl; K2Cr2O7 + H2S + H2SO4 → S+ Cr2(SO4)3 + K2SO4 + H2O. 170. См. условие задачи 162. KClO3 + Na2SO3 → KCl + Na2SO4; KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O. 171. См. условие задачи 162. Р + HClO3 + Н2О → Н3РО4 + HCl; H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O. 172. Cм. условие задачи 162. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O; FeS + HNO3 → Fe(NO3)2 + S + NO + H2O. 173. См. условие задачи 162. HNO3 + Zn → N2O + Zn(NO3)2 + H2O; FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O. 174. См. условие задачи 162. К2Сr2О7 + HCl → Cl2 + CrCl3 + KCl + H2O; Au + HNO3 + HCl → AuCl3 + NO + H2O. 175. Могут ли происходить окислительно-восстановительные реакции между веществами: а)NН3 и КМnО4; б) HNO2 и HI; в) HCl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме KМnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O. 176. См. условие задачи 162. HCl + CrO3 → Cl2 + CrCl3 + H2O; Cd + KMnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H2O. 177. См. условие задачи 162. Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O; MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O. 178. См. условие задачи 162. H2SO3 + HClO3 → H2SO4 + HCl; FeSО4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O. 179. См. условие задачи 162. I2 + Cl2 + H2O → HIO3 + HCl; K2Cr2O7 + Н3РО3 + H2SO4 → Cr2(SO4)3 + Н3РO4 + K2SO4 + Н2О.
180. Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВr; б) К2Сr2О7 и Н3РО3; в) HNO3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме AsH3 + HNO3 → H3AsO4 + NO2 + H2O. Т е м а 10. Электронные потенциалы и электродвижущие силы Стандартные электродные потенциалы (Е°) некоторых металлов (ряд напряжений Н.Н.Бекетова)
Контрольные вопросы 181. Есть два сосуда с голубым раствором медного купороса. В первый поместили цинковую пластинку, а во второй – серебряную. В каком сосуде цвет раствора постепенно исчезает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции. 182. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций. 183. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л. 184. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций. 185. Марганцевый электрод в растворе его соли имеет потенциал – 1,23 В. Вычислите концентрацию ионов Мn2+ (в моль/л). Ответ: 1,89·10-12 моль/л. 186. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)? Ответ: 0,20 моль/л. 187. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 В. 188. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 189. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89·10-12 моль/л. 190. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В. 191. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В. 192. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В. 193. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 194. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде. 195. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В. 196. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3·10-15 моль/л. 197. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Ni + Pb(NO3)2 = Ni(NO3)2 + Рb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, [Рb2+] = 0,0001 моль/л. Ответ: 0,064 В. 198. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора? 199. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий – никелевого аккумулятора? 200. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора? Т е м а 11. Электролиз Контрольные вопросы 201. Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 5,03 г; 6,266 л; 3,133 л. 202. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17,37 г/моль. 203. При электролизе раствора CuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ: 0,953 г. 204. Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,6 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 234. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 некоторых веществ
некоторых веществ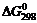 для следующих реакций (
для следующих реакций (  ):
): в этом процессе?
в этом процессе?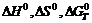 реакции, протекающей по уравнению
реакции, протекающей по уравнению