Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамический цикл КарноСтр 1 из 7Следующая ⇒ Законы термодинамики. Первый закон термодинамики Абсолютный по своему существу, один из наиболее общих законов природы – закон сохранения и превращения энергии. Согласно этому закону, энергия закрытой системы при любых процессах, происходящих в системе, остается неизменной. При этом энергия может только превращаться из одной формы в другую. Первый закон термодинамики является частным случаем этого всеобщего закона и представляет собой его приложение к процессам в термодинамических системах. Он устанавливает возможность превращения различных форм энергии друг в друга и определяет, в каких количественных соотношениях эти взаимные превращения осуществляются. Изменение энергии произвольной неизолированной системы может происходить в общем случае только за счет двух форм энергообмена – теплоты и работы: ∆E = Q –L , (1.12) где ∆ E – изменение энергии системы; Q – теплота, подведенная к системе; L– работа, совершенная над системой.
Согласно уравнению (1.12), изменение энергии термодинамической системы возможно за счет подведенной к системе теплоты и совершенной над системой работой. Значение первого закона: во-первых, он формирует принцип устройства теплоэнергетических установок и систем; во-вторых, он объясняет физическую сущность процессов, происходящих в тепловых машинах; в-третьих, он используется при расчетах термодинамических процессов и позволяет оценить энергетический баланс тепловых машин.
Второй закон термодинамики. 1. Для превращения теплоты в механическую работу необходимо иметь источник теплоты и холодильник, температура которого ниже температуры источника, т. е. необходим температурный перепад.  2. Нельзя осуществить тепловой двигатель, единственным результатом действия которого было бы превращение теплоты какого-либо тела в работу без того, чтобы часть теплоты не передавалась другим телам. Из этой формулировки можно сделать вывод, что невозможно построить вечный двигатель, совершающий работу благодаря лишь одному источнику теплоты, поскольку любой, даже самый колоссальный источник теплоты в виде материального тела не способен отдать тепловой энергии больше, чем ему позволяет энтальпия (часть полной энергии тела, которую можно превратить в теплоту, охладив тело до температуры абсолютного нуля). 3. Теплота не может сама по себе переходить от менее нагретого тела к более нагретому без затраты внешней работы. Второй закон термодинамики не имеет в своей основе формулярного содержания, а лишь описывает условия, при которых возможны те или иные термодинамические явления и процессы, подтверждая, по сути, общий закон сохранения энергии.
Параметры и функции состояния рабочего тела. Приборы для измерения параметров состояния рабочего тела. 1. Основные параметры состояния рабочего тела.
Основные термодинамические процессы. Термодинамический цикл.
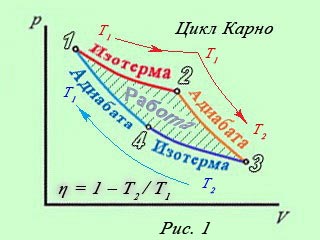
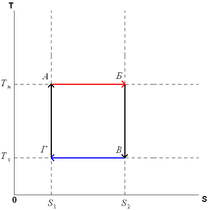
Термодинамический цикл Карно В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия). |
||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 485. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |