Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
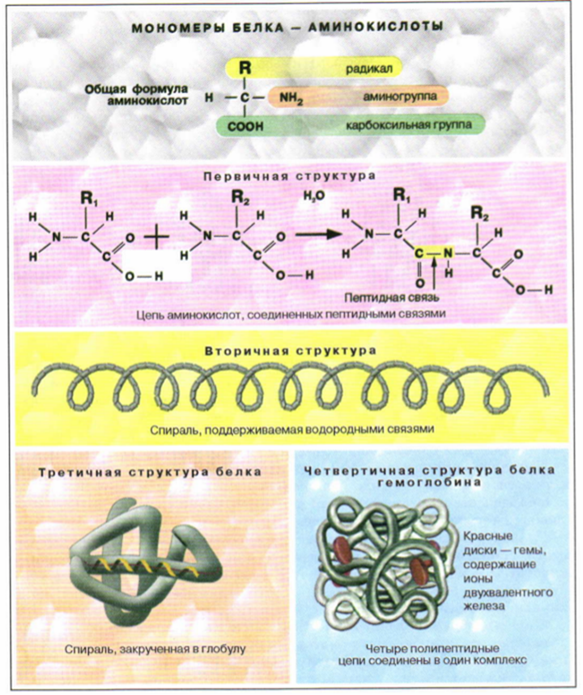
Органические вещества клетки: белкиБелки – биополимеры. Название «белок» впервые было дано веществу птичьих яиц, которое свертывается при нагревании в белую нерастворимую массу. Позднее этот термин распространился и на другие вещества с подобными свойствами, выделенные из живых организмов. С середины XX в. белки стали называть также «протеинами» (от греч. protos – первый), подчеркнув важность этих веществ для жизни. Белки – это сложные органические вещества. Молекулы белка состоят из атомов углерода, водорода, кислорода и азота. В некоторых белковых молекулах находятся атомы серы. Иногда белки образуют комплексы с другими молекулами, содержащими фосфор, железо, цинк, медь и т. д. Масса белковых молекул очень велика, поэтому их называют макромолекулами. Такие макромолекулы состоят из повторяющихся, сходных по структуре низкомолекулярных соединений – мономеров (от греч. monos – один, единый). Образованная мономерами макромолекула называется полимером (от греч. poly – много). Белки являются биополимерами, их мономерами служат аминокислоты. Структура белковых молекул. Для того чтобы белковая молекула нормально функционировала, она должна иметь совершенно определенную конфигурацию – структуру. Биологическая активность белков обусловлена необыкновенно гибкой и в то же время строго упорядоченной структурой. Для белковых молекул характерны разные уровни организации (структуры)первичная, вторичная, третичная и четвертичная (см. рис. 1).Первичная структура представляет собой цепь аминокислот, последовательно соединенных прочными ковалентными пептидными связями. Более высокий уровень организации белковой молекулы представляет собой вторичная структура. Это – спираль, поддерживаемая многочисленными водородными связями, менее прочными, чем пептидные связи.Большинство белков имеет еще и третичную структуру, поскольку спираль белковой молекулы свертывается в клубок – глобулу. Несколько молекул белков могут соединяться между собой, образуя четвертичную структуру. Такую структуру имеют, например, молекулы гемоглобина.Наиболее устойчива первичная структура белка, остальные легко разрушаются при различных воздействиях среды (температура, соли тяжелыхметаллов, кислотность и др,).  Первичная структура представляет собой цепь аминокислот, последовательно соединенных прочными ковалентными пептидными связями. Более высокий уровень организации белковой молекулы Свойства белков. Белки могут подвергаться денатурации и ренатурации. Денатурация заключается в нарушении природной структуры белковой молекулы в результате разрыва химических связей. Природная структура белка – это такая конфигурация молекулы, при которой белок выполняет присущие ему функции. Для белка кератина (он входит в состав кожи, волос, когтей, клюва, перьев и рогов позвоночных животных) природной является вторичная структура, для ферментов и антител – третичная, а для гемоглобина и хлорофилла – четвертичная. При денатурации изменяется не только структура белка, но и его свойства. Нарушение природной структуры белковой молекулы происходит под влиянием различных факторов среды; высоких температур, ультрафиолетового и рентгеновского излучения, сильных кислот и щелочей, органических растворителей, концентрированных растворов солей, тяжелых металлов и др. Денатурация может иметь обратимый и необратимый характер. Разрыв связей в первичной структуре приводит к необратимой денатурации (например, к свертыванию яичного белка при варке яиц). Разрыв связей, образующих третичную и даже вторичную структуру, – обратимая денатурация. Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает природную структуру, т. е. происходит процесс, противоположный денатурации, – ренатурация. Ренатурация возможна лишь в том случае, если не была нарушена первичная структура белка. Это говорит о том, что форма, а значит, и функция белка полностью зависят от первичной структуры. Функции белков. В клетке и в организме белки выполняют разнообразные функции. Структурная функция проявляется в том, что белки входят в состав внутриклеточных структур (например, плазматической мембраны), тканей и органов. Так, белок коллаген служит компонентом соединительной ткани, костей, сухожилий, хрящей; уже упомянутый кератин входит в состав производных эпидермиса: волос, ногтей, рогов, перьев.Ферментативная функция связана с тем, что все химические реакции в клетке протекают при участии биологически активных веществ – ферментов, которые являются белками. Ферменты – биологические катализаторы, т. е. они обеспечивают высокую скорость протекания всех биохимических реакций, идущих в клетках. Каждый фермент обеспечивает одну или несколько реакций одного типа (известно более 2 тыс. ферментов). Гормональная функция заключается в том, что некоторые гормоны являются по своей природе белками. Функция гормонов – регуляция обмена веществ в организме. Так, например, белки – гормоны инсулин и глюкагон регулируют обмен глюкозы. Транспортная функция связана с переносом белками некоторых веществ. Например, гемоглобин переносит кислород в крови позвоночных животных; гемоцианин переносит кислород в гемолимфе некоторых беспозвоночных; белок сывороточный (альбумин) обеспечивает транспорт жирных кислот и липидов. Защитная функция определяется тем, что глобулярные белки – антитела образуют комплексы с антителами (чужеродными белками) бактерий и вирусов, обеспечивая тем самым иммунные реакции организма. Кроме того, белки фибриноген, фибрин, протромбин и тромбин участвуют в процессах свертывания крови. Сократительная функция заключается в том, что белки (актин и миозин) обеспечивают мышечное сокращение. Некоторые белки, встроенные в плазматическую мембрану, способны воспринимать сигналы, идущие из внешней для клетки среды. В этом проявляется их сигнальная функция. Запасающая функция белков связана с тем, что некоторые белки способны запасать или удерживать определенные вещества. Примером может служить железоудерживающий белок – ферритин. При расщеплении 1 г белка выделяется 17,1 кДж (4,2 ккал) энергии, поэтому белкам присуща и энергетическая функция. Однако белки в качестве источника энергии используются клеткой только в том случае, когда истощены другие энергетические источники, а именно углеводы и жиры.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 325. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |