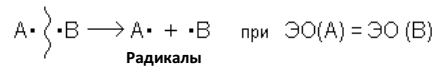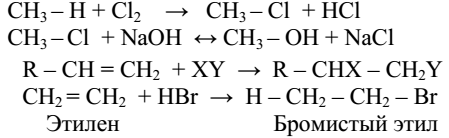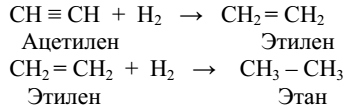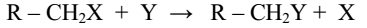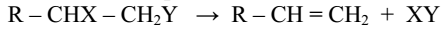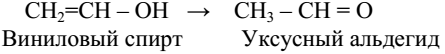Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
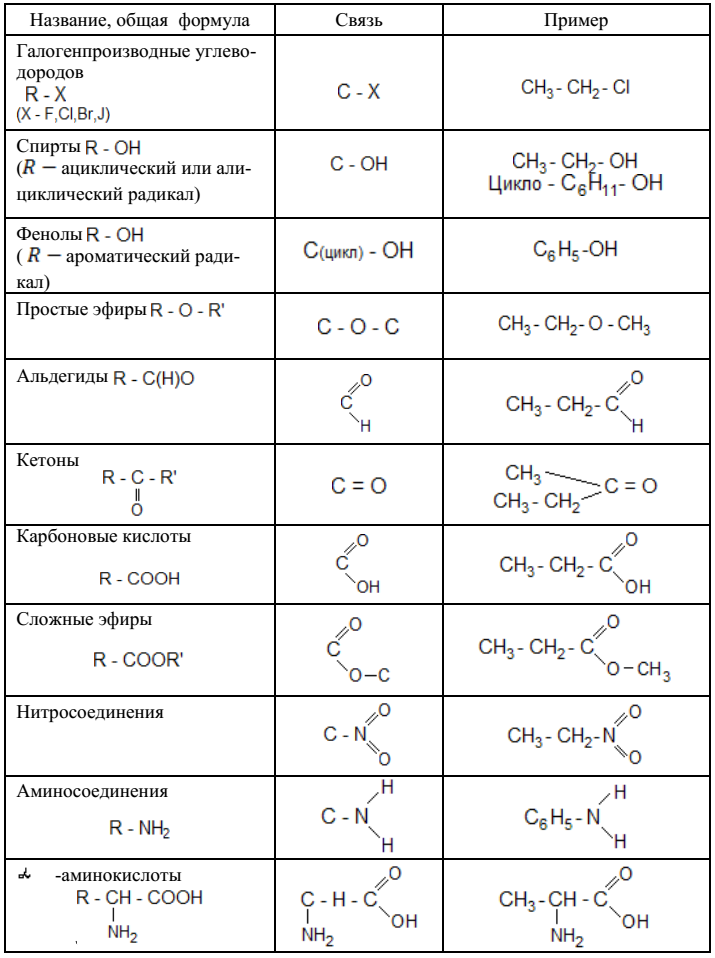
Классификация органических реакцийСтр 1 из 7Следующая ⇒ Важнейшие классы органических соединений
Общая характеристика органических реакций Реакции органических соединений подчиняются в принципе тем же законам, что и реакции неорганических соединений, хотя и имеют некоторые специфические особенности. В неорганических реакциях обычно участвуют ионы; реакции протекают очень быстро, иногда мгновенно и при нормальной температуре. В реакциях органических соединений обычно участвуют молекулы, при этом разрываются одни ковалентные связи и образуются новые. Эти реакции протекают медленнее ионных, часто десятки часов, а для их успешного осуществления во многих случаях необходимо применять повышенную температуру, повышенное давление и катализаторы. Органические реакции, в отличие от неорганических, редко приводят к высокому выходу продукта. Обычно протекает не одна, а несколько реакций, некоторые из которых при данных условиях преобладают. Поэтому выходы в таких реакциях редко достигают 
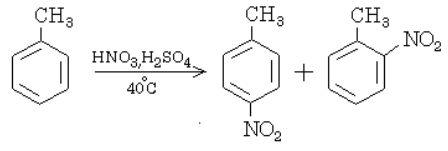
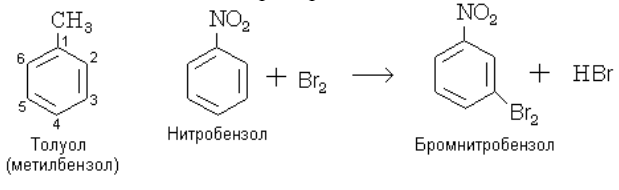
В незамещѐнном бензоле С6Н6 способность всех шести атомов водорода замещаться другими атомами или группами атомов одинакова. Заместитель может находиться у любого из шести атомов углерода. Однако если в бензольном кольце уже имеется какой-нибудь заместитель, то положение, которое займет новый заместитель, зависит от природы первого. Рассмотрим это на примерах. Пусть мы имеем толуол (метилбензол) и будем подвергать его нитрованию. Введенная в бензольное кольцо нитрогруппа будет находиться только либо в положении 2 (тоже 6), либо в положении 4: рядом (орто-положение) и через два атома углерода от первого заместителя (СН3)-(пара-положение). Такие заместители, которые ориентируют другие в орто- и пара-положения, называются заместителями первого рода. К ним относятся: – NH2; – OH; – CH3, а также галогены (F, Cl, Br, J). Заместители второго рода – NO2; – COOH; – CHO; – C ≡ N; – SO3H ориентируют другие заместители в положение через один, т. е. мета-положение. Например:
Классификация органических реакций Чаще всего органические реакции классифицируются по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций – радикальные и ионные. Радикальные реакции –это процессы, идущие с гомолитическим разрывом ковалентной связи. При гомолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате образуются свободные радикалы:
Нейтральный атом или частицу с неспаренным электроном называют свободным радикалом. Ионные реакции– это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц.
где ЭО – электроотрицательность атома. В результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная. Нуклеофильная частица (нуклеофил)– это частица, имеющая пару электронов на внешнем электронном уровне. За счёт пары электронов нуклеофил способен образовывать новую ковалентную связь. Электрофильная частица (электрофил) – это частица, имеющая свободную орбиталь на внешнем электронном уровне. Электрофил предоставляет незаполненные, вакантные орбитали для образования ковалентной связи за счѐт электронов той частицы, с которой он взаимодействует. Частицу с положительным зарядом на атоме углерода называют карбокатионом. Согласно другой классификации, органические реакции делятся на термические, являющиеся результатом столкновения молекул при их тепловом движении, и фотохимические, при которых молекулы, поглощая квант света hυ, переходят в более высокие энергетические состояния и далее подвергаются химическим превращениям. Кроме того, в органической химии реакции часто классифицируются также, как в неорганической химии – по структурному признаку. В органической химии все структурные изменения рассматриваются относительно атома (или атомов) углерода, участвующих в реакции. Наиболее часто встречаются следующие типы превращений: Присоединения
Замещения
3) отщепления (элиминирования)
Перегруппировка
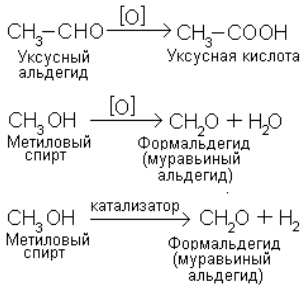
Кроме приведенных четырех типов механизмов реакций на практике употребляют также другие обозначения некоторых классов реакций. Окисление – реакция при которой под действием окисляющего реагента вещество соединяется с кислородом (либо другим электроотрицательным элементом, например галогеном) или теряет водород (в виде воды или молекулярного водорода):
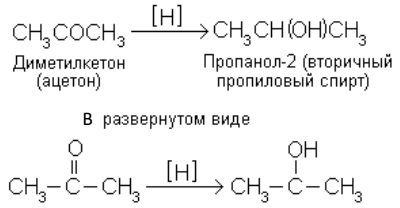
Отщепление водорода в последнем примере называется дегидрированием и проводится с помощью катализатора. Восстановление – реакция, обратная окислению. Под действием восстанавливающего реагента соединение принимает атомы водорода или теряет атомы кислорода:
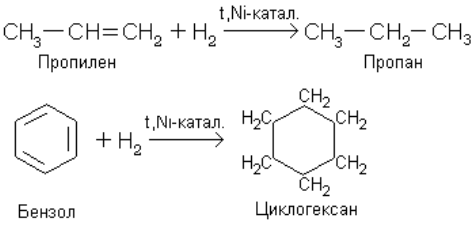
Гидрирование – реакция, представляющая собой частный случай восстановления. Водород присоединяется к кратной связи или ароматическому ядру в присутствии катализатора.
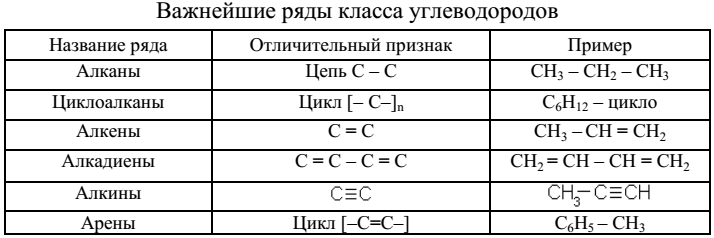
РАЗДЕЛ II. УГЛЕВОДОРОДЫ Углеводородами называют самые простые органические соединения, состоящие из углерода и водорода (табл. 2). В зависимости от характера связей и соотношения между количествами углерода и водорода они разделяются на: предельные и непредельные (этиленовые, ацетиленовые и т. д.).
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 605. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |