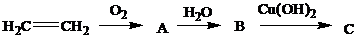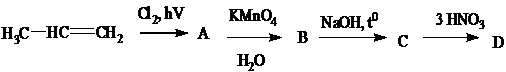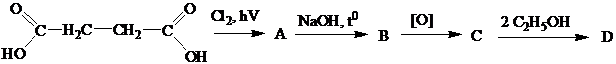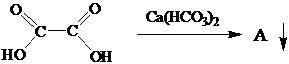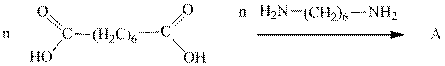Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Задания для самостоятельного решенияЗадание 1. Бромид калия используется в медицине как успокаивающее средство. Опишите аналитические эффекты, которые будут наблюдаться при добавлении к этому веществу: a) нитрата серебра b) перманганата калия в кислой среде Напишите уравнения химических реакций. Задание 2.Укажите применение в медицине: Na2SO4∙´ 10H2O, растворов NaCl, NaHCO3, Na2B4O7, KBr, KCl, CaCl2, суспензий MgO, MgSO4×7H2O, CaSO4, BaSO4. Задание 3.Запишите уравнения гидролиза карбоната и гидрокарбоната натрия, укажите рН раствора. Почему раствор гидрокарбоната натрия используется для полоскания горла при воспалении? Задание 4.Уравняйте следующие окислительно-восстановительные реакции: NaI + H2SO4 ® Na2SO4 + I2 +H2S +H2O NaClO3 +NaCl + H2SO4 ® NaHSO4 + Cl2 + H2O K2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O Задание 5.В чём заключаются функции кальция в организме? Почему магний считается эссенциальным элементом. Задание 6.В хирургической практике применяется раствор пероксида водорода с массовой долей 3%. Сколько надо миллилитров раствора пероксида водорода с массовой долей 26% (r =1,1г/мл), для приготовления 500 мл 3% раствора (r = 1,05 г/мл)? Ответ: 55 мл Задание 7.При некоторых заболеваниях в организм вводят раствор хлорида натрия с массовой долей 0,9%, называемый физиологическим. Вычислите сколько воды и соли нужно для приготовления 1 литра физиологического раствора, плотность которого 1,005 г/мл. Ответ: 9,04г NaCl и 996г воды Задание 8.Для нейтрализации щелочи, попавшей на кожу, применяется раствор борной кислоты с массовой долей 2%. Сколько насыщенного раствора борной кислоты, массовой долей 4,7% , понадобиться для приготовления 0,5л раствора с массовой долей 2%? Плотность принять равной 1 г/мл.  Ответ:212,8 мл Задание 9.В медицинской практике для промывания ран и полоскания горла применяется 0,5% раствор перманганата калия. Сколько граммов раствора, полученного растворением 6,4г этой соли в 100г воды и чистой воды необходимо для приготовления 1л 0,5% раствора? Плотность можно принять равной 1г/мл. Ответ: 83,3г и 916,7мл Н2О Задание 10.Перманганатом калия можно лечить змеиные укусы при отсутствии специальной сыворотки. Ддя этого в место укуса вводят шприцем 0,5-1,0 мл 1%-ного раствора KMnO4. Рассчитайте массу перманганата калия и объём воды, необходимый для приготовления 75 мл такого раствора, имеющего плотность 1,006 г/мл. Ответ:m(KMnO4)=0.754г, V(H2O)=75мл
ЗАНЯТИЕ № 7 ТЕМА:Химия элементов d-блока. Лигандообменные процессы. Строение металлоферментов, биокомплексных соединений. Задания для самостоятельного решения Задание 1. Определите степень окисления комплексообразователя, назовите комплексное соединение и выразите константу нестойкости: K3[Fe(CN)6] [Co(H2O)6]Cl3 K4[Fe(CN)6] KFe[Fe(CN)6] Задание 2. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями Hg+2. Задание 3. Из предложенных ниже молекул и ионов составьте комплексные соединения анионного, катионного и нейтрального типа (Pt+2, NН3, К+, С1-, Сu+2). Назовите их. Задание 4. В аналитической и медицинской практике используется ЭДТА (этилендиаминтетрауксусная кислота) и его соль Na2H2Т (трилон Б) С какими катионами: Со3+ (kн=2,51×10-41), Мg2+ (kн=7,59×10-10), Fe2+ (kн=6,31×10-15), Fe3+ (kн=5,89×10-25) он образует менее прочное комплексное соединение? Расположите комплексы по убыванию их прочности. Задание 5.Укажите, в состав каких ферментов входит кобальт: 1) карбоангидразы; 2) витамина В12 3) цитохромов 4) супероксиддисмутазы; 5) ксантиноксидазы Задание 6.При отравлениях ляписом (нитрат серебра) желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при взаимодействии 0,1 г нитрата серебра с избытком хлорида натрия. Ответ: m(AgCl)=0,084г Задание 7.Сульфат цинка ZnSO4 применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25г раствора ZnSO4 c массовой долей 2%, чтобы приготовить глазные капли? Ответ: 175 г воды. Задание 8.Массовая доля цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30мг) яда? Ответ: N (Zn)=1,38×1018 атомов
ЗАНЯТИЕ № 8 ТЕМА:Химия биогенных элементов р - блока.
Задания для самостоятельного решения Задание 1. К несолеобразующим оксидам относятся: 1) СО; 2) SiO2; 3) SiO; 4) SnO; Задание 2.Амфотерными свойствами обладают: 1) N2O3; 2) P2O3; 3) As2O3; 4)Al2O3; 5) Sb2O3 Задание 3.Чем объясняется токсическое действие СО? Задание 4..Раствор Люголя, применяющийся для смазывания слизистой оболочки полости рта и горла, содержит в 17 мл воды 1г йода и 2г иодида калия. Рассчитайте массовые доли йода и иодида калия в растворе Люголя. Ответ:ω(J2)=0,05; ω(KJ)=0,1 Задание 5.Для компенсации недостатка «соляной (хлороводородной) кислоты» в желудочном соке в качестве лекарственной формы применяют её растворы. Сколько миллилитров хлороводородной кислоты с массовой долей 24% (r = 1,12г/мл) необходимо для приготовления 200 мл 0,1 моль/л раствора HCl ? Ответ: 2,7 мл Задание 6.Питьевая сода (NaHCO3) входит в состав многих кулинарных рецептов, а также используется для полоскания горла в виде 2%-ного раствора. Сколько граммов соды нужно растворить в стакане воды объёмом 200мл для полоскания горла? Ответ: m(NaHCO3)=4,1г
ЗАНЯТИЕ № 9 ТЕМА: Физико-химия поверхностных явлений в функционировании живых систем.
Задачи для самостоятельного решения: Задача 1. Пользуясь правилом Дюкло-Траубе, определите во сколько раз поверхностная активность амилового спирта СН3(СН2)3СН2ОН больше поверхностной активности этилового спирта СН3СН2ОН. Задача 2. Опредлите, во сколько раз поверхностная активность цетилового спирта (С16Н33ОН) больше поверхностной активности гептанола (С7Н15ОН). Задача 3. Определите величину адсорбции водного раствора капроновой кислоты (С5Н11СООН) при 15оС, если ее концентрация составляет 0,25 моль/л, поверхностное натяжение раствора 35´10-3 Н/м, а поверхностное натяжение воды равно 73,4´10-3 Н/м. Задача 4. Определите величину адсорбции водного раствора пеларгоновой кислоты (С8Н17СООН) при 10оС, если ее концентрация составляет 0,05 г/л, поверхностное натяжение воды при указанной температуре равно 74,2´10-3 Н/м. Задача 5.Гmax для изоамилового спирта равна 7×10-6 моль/см2, молярная масса 88 г/моль, r = 0,81 г/см3. Определите толщину и площадь, занимаемую одной молекулой на поверхности раздела. Задача 6. Найдите площадь, приходящуюся на 1 молекулу в насыщенном адсорбционном слое анилина(С6Н5NH2) на поверхности его водного раствора, если предельная адсрбция равна 6,0 ´10-6 моль/см2.
ЗАНЯТИЕ № 10 ТЕМАФизико-химия дисперсных систем в функционировании живых систем.
Задания для самостоятельного решения: Задание 1. Напишите строение мицеллы CuS и AgI, если при электрофорезе они движутся к катоду. Определите заряд гранулы. Задание 2.Напишите строение мицеллы CaCO3, если при электрофорезе она движется к катоду. Определите заряд гранулы. Задание 3.Какова структура мицелла золя, если при его приготовлении использованы серная кислота и избыток хлорида бария? Задание 4.Напишите строение мицеллы AgJ, если при электрофорезе она движется к катоду. Определите заряд гранулы. Задание 5.Какой из электролитов (FeCl3, CuCl2, NaCl) будут иметь наименьший порог коагуляции для золя, гранула которого движется к аноду. Задание 6.Пороги коагуляции золя Fe(OH)3 для электролитов KJ и K2Cr2O7соответственно равны 10,0 и 0,195 ммоль/л. Во сколько раз коагулирующая способность бихромата калия больше, чем у иодида калия? Задание 7.Пороги коагуляции некоторого золя различными электролитами (NaNO3, CaCl2, NaJ) соответственно равны 50,0 0,8 и 49 ммоль/л. Определите соль, которая будет обладать наибольшей коагулирующей способностью. Задание 8.Какова структура мицеллы золя, если для его приготовления взять H2SO4 и избыток BaCl2. Задание 9.Какой из электролитов: KCl, Fe2(SO4)3, AlCl3, Na3PO4 будет иметь наименьший порог коагуляции для полученного золя?
ЗАНЯТИЕ № 11 ТЕМА: Полифункциональные соединения (многоатомные спирты и фенолы, полиамины, двухосновные карбоновые кислоты).
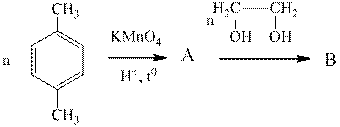
Задания для самостоятельного решения: Задание 1.Расшифровать цепочки превращений: А—Эпоскиэтан, В – Этиленгликоль, С- хелат Задание 2. .Расшифровать цепочки превращений:
А- 3-хлорпропен-1, В- 3-хлор-пропандиол1,2, С- глицерол D- тринитроглицерол Задание 3.Расшифровать цепочки превращений:
А- 2-хлорбутандиовая кислота; В- 2-гидрокси бутандиовая кислота С- щавелевоуксусная (2-оксобутандиовая) кислота D- диэтиловый эфир щавелевоуксусной кислоты Задание 4. Расшифровать цепочки превращений:
А- оксалат кальция Задание 5.Расшифровать цепочку превращений:
А- 1,4-бензолдикарбоновая (терефталевая кислота); В- полиэтиленгликольтерефталат (полиэфир, используется в хирургии как шовный материал). Задание 6.Расшифровать цепочку превращений:
А- полиамид - капрон, используется как шовный материал. Задание 7.По реакции с гидроксидом калия получите соли малоновой кислоты (малонаты), соли лимонной кислоты (цитраты), янтарной кислоты (сукцинаты); Задание 8.Получите соль по реакции кадаверина с хлороводородной кислотой. Задание 9. Напишите реакцию алкилирования и ацилирования кадаверина. Задание 10. Приведите формулы шестиатомных спиртов (сорбита, инозита.)
ЗАНЯТИЕ № 12 ТЕМА: Гетерофункциональные соединения (аминоспирты, гидрокси- и аминокислоты, оксокислоты.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 291. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |