
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Способы выражения состава растворовДОМАШНЕЕ ЗАДАНИЕ №1 1.«Строение вещества. Закономерности протекания химических процессов. Процессы в растворах» Строение вещества В соответствии с приведенным планом охарактеризуйте два предложенных элемента.
План характеристики элемента по порядковому номеру: 1. Установите состав атома: число протонов (заряд ядра), нейтронов, электронов. 2. Запишите электронную формулу атома, укажите внешний электронный уровень и орбиталь, на которую идет последний электрон. Сделайте вывод о типе элемента. Изобразите электронно-структурную формулу валентного уровня. 3. Используя электронную формулу, определите положение элемента в периодической системе Д.И. Менделеева. 4. Определите возможные значения степеней окисления. Укажите наиболее устойчивые степени окисления для данного элемента. Приведите примеры соединений данного элемента в этих степенях окисления. 5. Исходя из электронной формулы определите характер свойств простого вещества (металл/неметалл). Опишите физические свойства простого вещества. Приведите уравнения реакций характеризующие химические свойства простого вещества.  6. Запишите формулы и приведите уравнения реакций, характеризующие химические свойства характеристических соединений: высшего оксида и высшего гидроксида. 7. Сделайте вывод о причинах сходства и различия предложенных элементов.
Химическая связь и строение молекул С позиций метода валентных связей (МВС) объясните строение предложенных молекул. Укажите тип гибридизации центрального атома, изобразите перекрывание орбиталей, укажите порядки всех связей и их тип, определите, полярна ли данная молекула.
1.3. Окислительно-восстановительные реакции
Химическая кинетика 1.Период полураспада радиоактивного изотопа Cs, который попал в атмосферу в результате аварии на Чернобыльской АЭС, - 29,7 лет. Через какое время количество этого изотопа составит менее 1 % от исходного? 2.Определить период полураспада и сколько исходного вещества прореагировало за 45 мин в реакции второго порядка 2NO → N2 + O2, если константа скорости равна 47,059 л/(моль·мин.) и Co(NO) = 2,83 моль/л. 3.Определите период полураспада сколько вещества прореагировало за 28 мин. при равных начальных концентрациях исходных реагентов (0,1 моль/л), если константа скорости реакции равна 1,46·10-3 л/(моль·мин.) и стехиометрические коэффициенты в уравнении совпадают с периодом реакции по соответствующим реагентам: Н2 + J = 2HJ. 4.Константа скорости реакции PН3 → 1/2Р2 + 3/2Н2 равна 1,83·10-2 мин-1. Определите период полураспада, сколько вещества прореагирует за 80 мин, если исходная концентрация фосфина была равна 0,87 моль/л. 5.В необратимой реакции I порядка за 20 мин. при 125 °С степень превращения исходного вещества составила 60 %, а при 145°С такая же степень превращения бала достигнута за 5,5 мин. Найдите константы скорости и энергию активации данной реакции. 6.Реакция А + В = С является реакцией II порядка. Если исходные концентрации равны, то за 500 с реакция проходит на 20 %. За какое время она пройдет на 60 %? 7.Необратимые реакции I порядка за 20 мин. при 125°С прореагировало 50 % от исходного вещества. Рассчитайте, за какое время прореагирует 99 % исходного реагента. 8.Для некоторой реакции II порядка период полураспада равен 10 мин. при начальной концентрации исходных веществ 0,1 моль/л. Как изменится период полураспада, если начальная концентрация станет равной 0,2 моль/л? 9.Определите период полураспада сколько вещества прореагировало за 90 мин. при равных начальных концентрациях исходных реагентов 3,75 моль/л, если константа скорости реакции равна 3·10-4л/(моль·мин.) и стехиометрические коэффициенты в уравнении совпадают с порядком реакции по соответствующим реагентам: СО + Н2О = СО2 + Н2. 10.Константа скорости реакции I порядка СОСl = СО + ССl2 равна 5,3·10-3 мин-1. Определите период полураспада и сколько исходного вещества прореагирует за 10 мин., если начальная концентрация СOСl2 равна 0,8моль/л. 11.Реакция термического разложения этана является реакцией I порядка. Рассчитайте период полураспада этапа при 350 °С, если константа скорости равна 0,1 с-1. Определите, какое количество этана останется в системе через 1 с, если исходная концентрация равна 10 моль/л. 12.За 14 дней активность изотопа полония уменьшилась на 6,85 %. Определить константу скорости его распада, период полураспада и рассчитать, в течение какого промежутка времени он разлагается на 90 %. 13.Установлено, что реакция: C2H4Cl2 (г.) → С2Н3Сl (г.) + НС1 (г.) первого порядка и при 450 °С ее константа скорости равна 3,10·10-3 с-1. Вычислите время, за которое прореагирует половина исходного количества дихлорэтана. Сколько времени понадобится, чтобы дихлорэтан прореагировал на 90 %? 14.Гидролиз бутилацетата в щелочной среде - реакция II порядка. За сколько времени прореагирует 70 % эфира, если исходные концентрации эфира и NaOH одинаковы и равны 0,05 моль/л, а константа скорости этой реакции равна 3,93 л/(моль·мин)? 15.Установлено, что реакция: 2HI (г.) → I2 (г.) + Н2 (г.) протекает по II порядку. При равенстве начальной концентрации HI0,2 моль/л период полураспада равен 30 с. Определите константу скорости этой реакции и периоды полураспада при начальной концентрации HI0,02 моль/л. 16.Определить сколько вещества прореагировало с момента времени t при начальной концентрации Со. Н2 + Вr2 = 2НВr К = 8,56·10-2 л/(моль·мин) , t = 60мин, С0 = 0,03 моль/л. 17.Рассчитайте период полураспада и концентрацию исходного вещества через 15 с после протекания реакции СН3NН2 = HCN + 2Н2, если исходящая концентрация CH3NH2 равна 10-3 моль/л, а константа скорости при Т = 913К равна 5· 10-3 с-1. 18.Период полураспада радиоактивного изотопа 90Sr, который попадает в атмосферу при ядерных испытаниях - 28,1 лет. Предположим, что организм новорожденного ребенка поглотил 1 мг этого изотопа. Сколько стронция останется в организме через: а) 18 лет, б) 70 лет, если считать, что он не выводится из организма. 19.Реакция А + В = С является реакцией II порядка. Если исходные концентрации равны, то за 10 мин реакция происходит на 20 %. За какое время она пройдет на 70 %? 20.Определите время, необходимое для разложения бромистого этила на 90 % при 1000 К, если период полураспада равен 2,6·10-2 с, а исходная концентрация равна 1 моль/л: С2Н5Вr → С2Н4 + НВr. 21.В реакции, протекающей по мономолекулярному закону, период полураспада равен 1 с. Определите константу скорости реакции и количество вещества, не прореагировавшего к концу второй секунды. 22.Реакция гидролиза монохлоруксусной кислоты: СН2СlCООН + Н2O → СН2(ОН) СООН + НСl подчиняется кинетическому уравнению реакции I порядка. Определите период полураспада и количество прореагировавшего монохлоруксусной кислоты через 20 мин, если исходящая концентрация кислоты равна 0,1 моль/л, а константа скорости 7,31·10-2 мин-1. 23.Рассчитайте период полураспада и концентрацию исходного вещества через 10 с после протекания реакции I порядка 2F2O = 2F2 + O2, если начальная концентрация исходного реагента была равна 10 моль/л, константа скорости равна 1,04·10-4. 24.Рассчитайте период полураспада и концентрацию исходного вещества через 10 с для реакции I порядка N2O5 = N2O4 + ½ O2, если начальная концентрация была равна 0,1 моль/л, а константа скорости равна 7,9·10-7 (при 273 К). 25.Реакция НСНО + Н2O2 = НСООН + Н2O протекает по уравнению II порядка. При равных исходных концентрациях реагентов 0,5 моль/л через 2 часа при температуре 60°С СHCOOH будет равна 0,215 моль/л. Вычислите константу скорости, и определите, через сколько времени прореагирует 90 % исходного вещества. 26.Определите время, необходимое для распада некоторого вещества на 90 %, если период полураспада равен 2 часа, а процесс идет по уравнению первого порядка. 27.Константа скорости реакции I порядка SO2Cl2 → SO2 + Cl2 равна 6·10-5 мин-1. Определите период полураспада и концентрацию исходного вещества через 35 минут после начала реакции, если начальная концентрация SO2Cl2 была равна 2,5 моль/л. 28.Реакция II порядка А+D → В+С проводится в растворе с начальными концентрациями Cо(A) = 0,080 моль·л-1 и Cо(D) = 0,070 моль·л-1. Через 90 мин концентрация вещества D уменьшилась до 0,020 моль·л-1. Рассчитайте константу скорости и периоды полупревращения (образования или распада) веществ A, D. 29.Реакция второго порядка А+D → В+С проводится в растворе с начальными концентрациями Cо(A)= 0,060 моль·л-1 и Cо(B) = 0,080 моль·л-1. Через 60 мин концентрация вещества A уменьшилась до 0,025 моль·л-1. Рассчитайте константу скорости и периоды полупревращения (образования или распада) веществ А, В. 30.Период полураспада радиоактивного изотопа Cs, который попал в атмосферу в результате Чернобыльской аварии - 29,7лет. Через какое время количество этого изотопа составит менее 15 % от исходного. Химическая кинетика На основании значений констант скоростей реакции при двух температурах определить: энергию активации, константу скорости при температуре T3, температурный коэффициент скорости и количество вещества, израсходованного за время τ, если начальные концентрации равны C0. Принять, что порядок реакции и молекулярность совпадают.
Примечание: Размерность констант соответственно мин-1 (кмоль/м3) -1 (для реакции II порядка); * Принять, что реакция подчиняется уравнению реакции первого порядка. Химическая термодинамика Для указанной реакции вычислите ΔrH0298, ΔrG0T, KTравн. На основе расчетов сделайте вывод о тепловом эффекте процесса, его термодинамической возможности при заданных температурах и положении химического равновесия. Какие условия и как следует изменить для увеличения выхода продуктов реакции.
Гидролиз солей
Учитывая, что гидролиз идет по первой ступени, вычислите константу, степень гидролиза и pH в водном растворе соли по следующим данным:
Константы диссоциации соответствующих слабых электролитов см.: Рабинович В.А., Хавин З.Я. Краткий химический справочник. М: Химия, 1978, 392 с.
Растворы 1.Определите температуру замерзания 45 %-ного раствора хлорида натрия, если кажущаяся степень диссоциации NaCl в этом растворе равна 84,5%. Криоскопическая постоянная воды равна 2.Раствор, содержащий 0,933 г бромида натрия в 33,5 г воды, замерзает при температуре -0,944°С. Вычислите кажущуюся степень диссоциации бромида натрия в этом растворе 3.Чему равна степень диссоциации ортофосфата натрия в его 0,1 моль/кг растворе, температура кипения которого равна 100,17°С 4.Раствор 146 г хлорида щелочного металла в 5 кг воды (α = 70 %) замерзает при -1,6°С. Вычислите молекулярную массу металла
6.Чему равна степень диссоциации хлорида кальция в его одномоляльном растворе, температура кипения которого равна -5,46°С. 7.Раствор, содержащий 2,85 г сульфата калия в 100 г воды, кипит при температуре 100,191°С. Вычислите кажущуюся степень диссоциации сульфата калия. Эбуллиоскопическая постоянная воды равна 8.Раствор, содержащий 1,7 г хлорида цинка в 250 г воды, замерзает при температуре -0,23°С. Определите кажущуюся степень диссоциации хлорида цинка в этом растворе. 9. Раствор, содержащий бромид натрия массой 0,933 г в воде массой 33,5 г, замерзает при температуре 0,944°С. Вычислите кажущуюся степень диссоциации NaBr в этом растворе. Криоскопическая постоянная воды равна 10.Температура замерзания раствора хлорида кальция массовой долей 2,5 % равна -1,2°С. Определите кажущуюся степень диссоциации соли в этом растворе. Криоскопическая постоянная воды равна 11.Сколько грамм свекловичного сахара содержится в воде массой 100 г, если этот раствор замерзает при той же температуре, что и раствор хлорида калия молекулярной концентрацией 0,1 моль/кг? Кажущаяся степень диссоциации соли равна 83 %. Криоскопическая постоянная воды равна 12.Раствор, содержащий хлорид аммония массой 0,75 г в воде массой 100 г, кипит при температуре 100,128°С. Вычислите кажущуюся степень диссоциации хлорида аммония в этом растворе. Эбуллиоскопическая постоянная воды равна
14.Раствор, содержащий 1,5 г КСlв 100 г Н2О, замерзает при температуре -0,684°С. Определить изотонический коэффициент, степень диссоциации и давление пара этого раствора при 25°С, если давление пара воды при этой температуре равно 23,756 мм рт.ст. Криоскопическая постоянная воды равна 15.Раствор, содержащий сульфат калия массой 2,85 г в воде массой 100 г, кипит при температуре 100,191°С. Вычислить кажущуюся относительную молекулярную массу и кажущуюся степень диссоциации, если эбуллиоскопическая постоянная воды равна 16.При 75°C давление паров воды равно 138,5 кПа. При растворении в воде массой 100 г хлорида бария массой 3,4 г, давление пара понизилось на 0,51 кПа. Вычислите кажущуюся степень диссоциации хлорида бария. 17.Водный 7,5% раствор хлорид кальция кипит при 374 К, при этом давление раствора равно 101,325 кПа. Найти кажущуюся степень диссоциации. Давление пара воды при 374 К равно 105 кПа. 18.Давление пара раствора содержащего 2,21 г CaCl2 в 100 г воды при 293 К равно 2321 Па, а давление пара воды при той же температуре 2339 Па. Вычислить кажущуюся степень диссоциации. 19.Атмосферное давление таково, что чистая вода кипит при 372,4 К. При какой температуре будет кипеть раствор 3,291 г хлорид кальция в 100 г воды. Кажущая степень диссоциации раствора -68 %. Эбуллиоскопическая постоянная воды равна 20.Рассчитайте, при какой температуре замерзает раствор, содержащий 74,4 г сульфата магния, в 20 кг воды (α = 75%), 21.Раствор 59,2 г хлорида щелочного металла в 2 кг воды (α = 70 %) замерзает при -1,6°С. Вычислите молекулярную массу металла. 22.Найдите массу хлорида натрия, который растворили в 1,5 л воды, если полученный раствор (α = 72 %) замерзает при -1,53°С. 23.Рассчитайте степень электролитической диссоциации сульфата магния в 0,01 моль/л растворе, замерзающем при -0,027°С. Плотность раствора принять равной 1,015 г/см3. 24.Чему равна степень диссоциации ортофосфата натрия в 0,1 моль/л растворе, кипящем при 100,17°С. Плотность раствора 1,007 г/см3. 25.Чему равна степень диссоциации хлорида алюминия в его 0,5 моль/л растворе, кипящем при 100,91°С. Плотность раствора 1,060г/см3.
Способы выражения состава растворов Рассчитайте: а) массовую долю растворенного вещества; б) молярную концентрацию; в) моляльность раствора; г) мольную долю растворенного вещества растворов, полученных при растворении веществ в воде.
ДОМАШНЕЕ ЗАДАНИЕ № 2 2. «Электрохимические процессы. Коррозия металлов» Гальванические элементы 1.Составьте схему, напишите уравнения электродных процессов и суммарной реакции элемента, один из электродов которого стандартный хлорный, а второй - цинковый с 2..Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у которого один электрод кадмиевый с 3.Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у элемента которого один электрод цинковый с 4.Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у элемента которого один электрод кадмиевый с 5.Составьте схему, напишите уравнения электродных процессов и суммарной реакции (Т = 298 К) элемента, у которого один электрод цинковый с 6.Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у которого один электрод литиевый с 7.Составьте схему, напишите уравнения электродных процессов элемента, состоящего из серебряной и свинцовой пластин, опущенных в раствор, содержащий собственные ионы с 8.Составьте схему, напишите уравнения электродных процессов элемента, состоящего из медной и кадмиевой пластин, опущенных в раствор, содержащий собственные ионы с 9.Рассчитайте ЭДС при Т = 298 К и напишите уравнения электродных процессов для гальванического элемента. Cr|Cr3+ (0,1 моль/л) || Au3+ (0,001 моль/л) | Au 10. Рассчитайте ЭДС гальванического элемента при Т = 298 К и напишите уравнения электродных процессов для гальванического элемента. Zn|Zn2+ (0,01 моль/л) || Hg2+ (0,01 моль/л) | Hg 11. Рассчитайте ЭДС при Т = 298 К и напишите уравнения электродных процессов для гальванического элемента. Pb| Pb 2+ (0,001 моль/л) || Ag+ (0,01 моль/л) | Ag 12.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором 13.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 М, а второй - в 0,1 М растворы AgNO3. 14.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод в 0,01 М растворе сульфата никеля. 15.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией 16.Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией 17.Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если 18.Составьте схему гальванического элемента, в основе работы которого лежит реакция, протекающую по уравнению: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если 19.Составьте схему, напишите уравнения электродных процессов элемента состоящего из свинцовой и цинковой пластин, опущенных в раствор, содержащих собственные ионы с 20.Составьте схему, напишите уравнения электродных процессов элемента, состоящего из алюминиевой и серебреной пластин, опущенных в раствор AlCl3 (0,1 М) и AgNO3(0,1 М). Рассчитайте ЭДС этого элемента. 21.Составьте схему и рассчитайте ЭДС элемента при 298 К, в основе работы которого лежит реакция: Zn + Sn2+ = Zn2+ + Sn при 22.Составьте схему и рассчитайте ЭДС элемента при 298 К, в основе работы которого лежит реакция: Fe + 2Ag+ = Fe2+ + 2Ag при 23.Составьте схему и напишите уравнения электродных процессов и суммарной реакции элемента у которого один электрод кадмиевый с 24.Составьте схему, напишите уравнения электродных процессов элемента, состоящую из никелевой и свинцовой пластины, опущенных в раствор, содержащий собственные ионы с 25.Составьте схему и напишите уравнения электродных процессов и суммарной реакции элемента у которого один электрод алюминиевый с
Электролиз 1.В течение какого времени ток силой 10 А должен проходить через электролитическую ячейку, содержащую расплавленный хлорид натрия, чтобы на катоде образовался металлический натрий массой 69 г? Определите массу хлора, выделившегося на аноде. 2.При электролизе соли трёхвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. 3.Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. 4.Раствор CuSO4 подвергается электролизу с медным катодом и платиновым анодом. За время электролиза на катоде отложилось 6,35 г меди. Выделившийся на аноде кислород измерен при давлении 1,013·105 Па. Каков объём газа? Сколько времени продолжался электролиз, если сила тока равна 0,1 А? 5.Сколько и каких продуктов можно получить в результате пропускания тока силой 10 А через электролизер в течение часа, если электролизер заполнен: а) расплавом иодида серебра; б) разбавленным водным раствором иодида серебра. 6.Раствор сульфата никеля подвергали электролизу током в 15 А в течение часа. На катоде выделились никель и водород, при этом 60 % напряжения было израсходовано на выделение никеля. Какова масса никеля, выделенная на катоде? Каков объём водорода, если электролиз проводился при нормальных условиях? 7.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 л газа? Сколько литров газа (н. у.) выделилось при этом на катоде? 8.Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. 9.При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. 10.При электролизе раствора CuSO4 на аноде выделилось 168 см3 (н. у.) газа. Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. 11.Ток силой 3 А пропускался в течение 3 часов через водный раствор CuSO4. Каков выход по току металлической меди, если за указанное время на катоде выделилась медь массой 9,162 г? 12.Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 A. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объём газов (н. у.), выделившихся на катоде и аноде? 13.Электролиз раствора CuSO4 проводили в течение 15 мин при силе тока 2,5 А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по току. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 239. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 .
.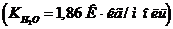 .
. .
. .
. . К слабым или сильным электролитам относится бензойная кислота?
. К слабым или сильным электролитам относится бензойная кислота? . Рассчитайте ЭДС этого элемента при 298 К.
. Рассчитайте ЭДС этого элемента при 298 К.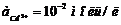 , а второй - кислородный при стандартном давлении О2 при рН=1. Рассчитайте ЭДС этого элемента при 298 К.
, а второй - кислородный при стандартном давлении О2 при рН=1. Рассчитайте ЭДС этого элемента при 298 К. , а второй - хлорный со стандартным давлением хлора и с
, а второй - хлорный со стандартным давлением хлора и с  . Рассчитайте ЭДС этого элемента для 298 К.
. Рассчитайте ЭДС этого элемента для 298 К. , а второй водородный со стандартным давлением водорода и рН = 10. Рассчитайте ЭДС этого элемента.
, а второй водородный со стандартным давлением водорода и рН = 10. Рассчитайте ЭДС этого элемента. . Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов уменьшить в 10 раз?
. Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов уменьшить в 10 раз? . Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов возрастает в 10 раз?
. Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов возрастает в 10 раз? , а
, а  .
. . Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое количество раз?
. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое количество раз? . Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л?
. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? ?
?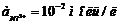 , а
, а  .
. и
и  ,
,  .
. ,
,  .
. , а второй водородный при стандартном давлении водорода и рН = 3. Рассчитайте ЭДС этого элемента при 298 К.
, а второй водородный при стандартном давлении водорода и рН = 3. Рассчитайте ЭДС этого элемента при 298 К. и
и  . Рассчитайте ЭДС этого элемента при 298 К.
. Рассчитайте ЭДС этого элемента при 298 К.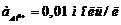 , а второй кислородный при стандартном давлении кислорода и рН = 1. Рассчитайте ЭДС этого элемента при 298 К.
, а второй кислородный при стандартном давлении кислорода и рН = 1. Рассчитайте ЭДС этого элемента при 298 К.