
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.1. Соблюдайте осторожность при работе с термометром и с раствором щелочи. 2 В случае попадания щелочи на одежду следует смыть её водой, а затем нейтрализовать раствором уксусной кислоты с массовой долей 5%. 3.При попадании на лицо, глаза и на руки химических реактивов следует промыть пораженный участок большим количеством воды. 4.Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 2. Зависимость скорости реакции от концентрации реагирующих веществ и температуры. 1. ЦЕЛЬ РАБОТЫ: Установить зависимость скорости реакции от концентрации реагирующих веществ . 2. РАБОЧЕЕ ЗАДАНИЕ: Проделать опыты. Ответить на контрольные вопросы. ОБЩИЕ СВЕДЕНИЯ ПОНЯТИЕ О СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ. Скоростью химической реакции (υ) называется изменение концентрации реагирующих веществ в единицу времени. По изменении концентрации одного из веществ, участвующих в реакции можно судить об изменении концентрации всех остальных веществ. Пусть за промежуток времени от
где:
υср – скорость реакции, [моль/л*сек; моль/см3*мин] Различают гомогенные и гетерогенные реакции. Реакции, протекающие в однородной среде, называют гомогенными. Эти реакции идут по всему объёму системы Гетерогенными называют реакции, идущие на поверхности соприкосновения твёрдого вещества и газа, твёрдого вещества и жидкости.  1)Н2(г)+J2(г)=2НJ(г)-гомогенная реакция 2)2Nа(тв)+2Н2О(ж)=2NаOH(р-р)+Н2(г)-гетерогенная реакция. Для гетерогенных процессов скорость определяется изменением концентрации реагирующих веществ или образовавшихся в ходе реакции за единицу времени на единице поверхности.
Факторы, влияющие на скорость химической реакции. Влияние природы реагирующих веществ. Природа реагирующих веществ оказывает очень существенное влияние на скорость хим. реакций. Так, например, щелочные металлы натрий и калий с одним и тем же веществом – водой реагируют с разными скоростями. Атомы калия имеют большой радиус и поэтому свои электроны отдают гораздо энергичнее, чем атомы натрия, поэтому реакция калия идет гораздо быстрее. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 203. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

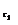 до
до  концентрации некоторых веществ изменились с
концентрации некоторых веществ изменились с  до
до  . Тогда средняя скорость реакции в среднем интервале времени равна:
. Тогда средняя скорость реакции в среднем интервале времени равна: 

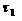 и
и  – время, [мин, сек];
– время, [мин, сек];
