
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ РЕАКИИ ОКИСЛЕНИЯ ТВЕРДОГО УГЛЕРОДА ДИОКСИДОМ УГЛЕРОДАМетодичні вказівки До виконання домашнього завдання по дисципліні "Теорія металургійних процесів"
Галузь знань – 0504 " Металургія та матеріалознавство " напрям підготовки – 6.050401 „ Металургія ” освітньо-кваліфікаційний рівень – бакалавр Алчевськ, 2009 1 ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ Цель работы: применение термодинамики реакций восстановления, оксидов железа оксидом углерода и водородом для расчетов равновесных составов газовых фаз и анализа восстановительных процессов. Теоретические основы Восстановление оксидов железа оксидом углерода и водородом. По схеме А. А. Байкова осуществляется последовательное восстановление оксидов железа от высшего к низшему и металлу. При температуре выше 570°С (843 К) в превращениях участвуют все оксиды железа. Восстановление оксидом углерода: 1) 3Fe2O3 + CO = 2Fe3O4 +CO2 +ΔH1 ; ΔG10 = -52130 - 41,0 T Дж, (1.1) 2) Fe3O4 +CO = FeO + CO2 +ΔH2 ; ΔG20 = 35380 - 40,16 T Дж, (I. 2) 3) FeO + CO = Fe +CO2 + ΔH3; ΔG30= -13160 + 17,21 ТДж, (I. 3) При температуре ниже 843 К происходит непосредственное восстановление Fe3O4 до железа по реакции: 4) l/4Fe3O4 +CO = 3/4Fe + CO2 + ΔH4; ΔG40= -1030 +2,96 Т Дж. (1. 4) Константы равновесия этих реакций выражают отношением равновесных парциальных давлений СОа и СО:
и вычисляют по уравнениям: KPi = exp(-ΔG /RT). (1.6) Реакции восстановления оксидов железа водородом и их термодинамические функции приведены ниже: |  l)3Fe2O3 + H2 = 2Fe3O4 + H2O + ΔH1; ΔG10 = -15547 - 74,46 Т Дж; (1.7 ) При температуре ниже 843 К не образуется FeO и протекает реакция: 4) l/4Fe3O4 + Н2 = Fе + Н2О + ΔH4; ΔG40 =35550 - 30,40 Т, Дж (1.10) Константы равновесия По правилу фаз для трех компонентов и трех фаз (две твердые + газовая фаза): С=К+2 — Ф=3 + 2 — 2= 2, т.е. нужно задавать температуру и давление для определения равновесного состава газовой фазы. Общее давление равно сумме равновесных давлений газовых компонентов. Напишем систему уравнений:
(для реакций восстановления водородом система выглядит аналогично). Отсюда pCO = p/(1+Kp) Соответсвенно
(для реакций восстановления водородом – аналогично). Задача. Рассчитать равновесные составы газовой фазы в реакциях восстановления оксидов железа водородом при температуре 1473 К, РΣ =1. Решение. При Т= 1473 К по реакциям (I.7), (1.8), (1.9) восстановления оксидов железа водородом: ΔG10 = -15547 - 74,46 Т = -15547 - 74,46*1473 = - 125227 Дж,
ΔG20 = 71940 - 73,62 Т = 71940 - 73,62 *1473 = -36502 Дж,
ΔG30 = 23430 - 16,16 Т = 23430 - 16,16*1473 = -373,68 Дж,
Для реакции (1.7) : рН2 = рΣ/(1+27735) = 0,000036рΣ. {Н2} = 4,8 %, {H2O} = 95,2 %; для реакции (1.9) {Н2} = 49,3 %, {H2O} = 50,7 %. Расчетное задание. Определить равновесные составы газовых фаз реакций восстановления оксидов железа монооксидом углерода при заданной температуре. Результаты расчетов сравнить с точками на равновесных кривых оксидов железа с газовыми фазами СО-СО2 (рис.1).
Рис. 1 Диаграмма равновeсия оксидов железа с атмосферой СО-СО2 Варианты задания 1
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ РЕАКИИ ОКИСЛЕНИЯ ТВЕРДОГО УГЛЕРОДА ДИОКСИДОМ УГЛЕРОДА Цель работы: применение термодинамики реакций горения углерода для расчетов равновесных составов газовых фаз. Теоретические основы Реакция взаимодействия углерода с СО2 С + СО2 = 2СО получает значительное развитие в доменных печах и является эндотермической. Константа равновесия реакции
С другой стороны величину Кр можно рассчитать по термодинамическим характеристикам реакции
Таким образом, задавая температуру по уравнению (2) можно рассчитать lg Kp, а затем и Kp. Подставив полученное значение в(1) и задаваясь Робщ, получим квадратное уравнение относительно %СО. Решая это уравнение находим %СО. Соответственно %СО2 = 100 - %СО, поскольку газовая фаза состоит только из этих двух газов. Расчетное задание. Определить равновесные составы газовых фаз реакии окисления твердого углерода диоксидом углерода при заданном давлении и в интервале температур (через каждые 1000 С). Результаты расчетов нанести на график (рис. 1 из первого задания) Варианты задания 2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 207. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 (1. 5)
(1. 5) вычисляют по уравнениям
вычисляют по уравнениям 


 = 27735,
= 27735, = 19,73,
= 19,73, = 1,03.
= 1,03.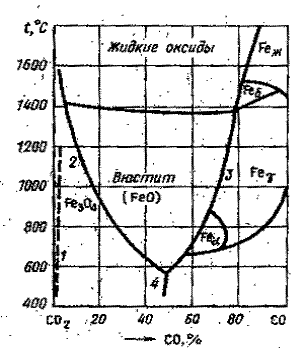

 (1)
(1) (2)
(2)