Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВСовременные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в г. Москве. В основу классификации легли три принципа: 1. Химическая природа фермента. 2. Химическая природа субстрата, на который действует фермент. 3. Тип катализируемой реакции. Существует шесть классов ферментов.
Аэробные дегидрогеназы, или оксидазы, катализируют перенос протонов (электронов) непосредственно на кислород; Анаэробные дегидрогеназы ускоряют перенос протонов (электронов) на промежуточный субстрат, но не на кислород. Наиболее распространены оксидоредуктазы, содержащие в качестве кофактора никотинамидадениндинуклеотид (НАД+), либо никотинамидадениндинуклеотидфосфат(НАДФ+). Их называют пиридинферментами. Коферментами оксидоредуктаз являются также флавопротеины (ФП) – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Подобные ферменты получили название флавиновых дегидрогеназ.  2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Фосфотрансферазыкатализируютперенос остатка фосфорной кислоты. Донором фосфатных остатков в большинстве случаев является АТФ. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Реакция фосфорилирования глюкозы катализируется гексокиназой или АТФ,D-глюкоза-6-фосфотрансеразой: Протеинкиназыпереносят остаток фосфата с АТФ на белки,изменяя их биологическую активность. Аминотрансферазыускоряют реакцию переноса аминогруппы с аминокислоты на a-кетокислоту:

аспарагиновая α-кетоглутарат оксалоацетат глутаминовая кислота кислота Гликозилтрансферазыкатализируют реакции переноса гликозильных остатков; ацилтрансферазы– реакции переноса ацилов (остатков карбоновых кислот). 3. Гидролазыкатализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
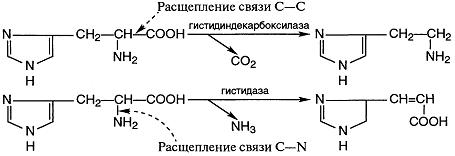
Фосфатазыгидролизуют фосфорные эфиры: Г-1-Ф + Н2О Гликозидазыкатализируют гидролиз гликозидов. Амилаза расщепляет гликозидные связи в молекулах крахмала. Пептидгидролазыускоряют гидролиз пептидных связей в белках и пептидах. 4. Лиазы- ферменты, катализирующие разрыв связей С—О, С—С, Декарбоксилазы относятся к углерод-углерод-лиазам:
Некоторые лиазы ускоряют реакции не только отщепления, но и присоединения. 5. Изомеразы- ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров. Мутаротазаускоряет реакцию превращения α-D-глюкопиранозы в
6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии АТФ либо других веществ: пируваткарбоксилаза СН3-СО-СООН + СО2 + АТФ ----------------------------à НООС-СН2-СО-СООН + АДФ + Рi. пировиноградная оксалоацетат кислота Международная комиссия подготовила Классификацию ферментов (КФ).Код каждого фермента содержит четыре цифры, разделенные точками. Первая цифра указывает номер класса, вторая означает подкласс и характеризует вид субстрата (у трансфераз указывает на природу переносимой группы, у гидролаз - на тип гидролизуемой связи). Третья цифра уточняет природу участвующих в реакции соединений или групп. Четвертая цифра – номер фермента в данном подподклассе. В подподклассе ферменты располагаются по алфавиту. Пример: каталаза – 1.11.1.6. ФЕРМЕНТЫ В МЕДИЦИНЕ Ферменты применяют как лечебные препараты(таблица 2): - при их отсутствии или недостатке (наследственном или приобретенном); - для специфического разрушения некоторых продуктов обмена.
Таблица 2. Использование ферментов как лечебных препаратов
Ферменты используют в клинике в качестве аналитических реактивов (таблица 3). Для анализа часто применяются иммобилизованные ферменты, которые искусственно связаны с нерастворимым в воде носителем, что облегчает использование и повышает стабильность ферментов. Таблица 3. Использование ферментов как аналитических реагентов
Анализ кинетики появления и исчезновения ферментов в сыворотке крови используется в диагностике. Состав ферментов и их распределение в тканях у взрослого человека в норме в основном постоянны, и могут изменяться при болезнях. Почти все ферменты организма функционируют внутриклеточно. При повреждении тканей внутриклеточные ферменты появляются в сыворотке крови. При воспалительных процессах повышается проницаемость клеточных мембран и в сыворотку крови попадают цитоплазматические ферменты. Некроз ткани сопровождается разрушением всех клеточных структур, и в сыворотке могут быть обнаружены митохондриальные, ядерные и другие ферменты. Такие ферменты называют индикаторными. Появление в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах характеризует функциональное состояние различных органов и их поражение (таблица 4). Таблица 4. Использование ферментов в диагностике
Энзимопатии (синоним ферментопатии) - общее название болезней, развивающихся вследствие отсутствия или снижения активности тех или иных ферментов. Дефект одного фермента часто приводит к ряду нарушений в обмене веществ вследствие взаимозависимости метаболический процессов в организме. Выделяют наследственные и приобретенные энзимопатии. 1. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов. Известно более 150 наследственных ферментопатий, для которых установлена сущность генной мутации. Ферментативный дефект приводит к накоплению в организме продуктов обмена веществ, нарушающих функцию тех или иных органов, что обусловливает появление клинических признаков болезни. К энзимопатиям относятся фенилкетонурия, гликогенозы, хондродистрофия, гемофилия и т.д. Приобретенные энзимопатии. Токсические энзимопатии - следствие токсического воздействия ксенобиотиков и мутагенов внешней среды. Например, свинец, содержащийся в выхлопных газах транспорта, вызывает снижение активности фермента аминолевулинатдегидразы, участвующей в синтезе гема, что проявляется развитием анемии у детей крупных городов. Алиментарные энзимопатии могут быть обусловлены длительным несбалансированным питанием, дефицитом белка в рационе, витаминной недостаточностью. Контрольные вопросы 1. Охарактеризуйте химическую природу и строение ферментов. 2. Каково строение активного центра фермента? 3. Что такое аллостерический центр? 4. Приведите примеры изоферментов; мультимолекулярных ферментных систем. 5. Опишите механизм действия ферментов. 6. В чем различие теорий Фишера и Кошленда? 7. Каким образом влияют изменение рН и температуры на скорость ферментативных реакций? 8. Что понимают под специфичностью действия ферментов? 9. Что такое константа Михаэлиса? Что она характеризует? 10. Как осуществляется регуляция активности ферментов? 11. В чем отличие обратимого и необратимого ингибирования? 12. Как изменяются Кm и umax при различных типах обратимого ингибирования? 13. Что общего и раздичного в механизмах неконкурентного и бесконкурентного ингибирования ферментов? 14. Приведите примеры использования ингибирования ферментов в медицине. 15. Чем обусловлено существование энзимопатий? 16. По какому признаку классифицируют ферменты? 17. Приведите примеры биохимических реакций, катализируемых ферментами всех шести классов. 18. Какой принцип лежит в использовании ферментов в медицине в диагностических целях? 19. Как на практике можно осуществить определение активности ферментов? 20. Приведите примеры использования ферментов как лекарственных препаратов. ВИТАМИНЫ Витамины (от лат. vita - жизнь) – пищевые незаменимые факторы, которые, присутствуя в небольших количествах в пище, обеспечивают нормальное развитие и жизнедеятельность организма человека и животных, адекватную скорость протекания биохимических и физиологических процессов. Витамины – группа разнообразных по химическим и физическим свойствам органических соединений. Физиологическое действие витаминов также весьма различно. Еще 100 лет назад считали, что для нормальной жизнедеятельности организма человека достаточно поступления белков, жиров, углеводов, минеральных веществ и воды. Оказалось, что существуют особые болезни, развитие которых связано с неполноценным питанием (цинга, бери-бери). Витамины были открыты в 1880 г. нашим соотечественником Н.И. Луниным. На связь витаминов с ферментами впервые в 1922 г. указал академик Н.Д. Зелинский. Во многих случаях витамины являются составными частями ферментов. В количественном отношении потребность в витаминах ничтожна: человек в среднем должен потреблять ежедневно 0,1-0,2 г витаминов. Авитаминозы – болезни, возникающие при полном отсутствии в пище или полном нарушении усвоения какого-либо витамина. Гиповитаминозы – недостаточное поступление витаминов с пищей или неполное их усвоение. Гипервитаминозы – патологические состояния, связанные с поступлением чрезмерно больших количеств витаминов в организм. Причины гипо- и авитаминозов у человека и животных обычно делят на экзогенные и эндогенные. К экзогеннымотносится недостаточное поступле витаминов или полное отсутствие их в пище. Эндогенными причинами служат: а) повышенная потребность в витаминах при некоторых физиологических и патологических состояниях (беременность, тиреотоксикоз); б) нарушение процесса всасывания витаминов при заболеваниях пищеварительного тракта; в) усиленный распад витаминов в кишечнике вследствие развития в нем микрофлоры; г) болезни печени, поджелудочной железы, сопровождающиеся нарушением всасывания жиров и, соответственно, жирорастворимых витаминов. Витамины классифицировали по физиологическому действию, оказываемому на организм человека (например, антианемические, антигемморагические, антиинфекционные и т.д.). В настоящее время используется классификация, основанная на растворимости витаминов.
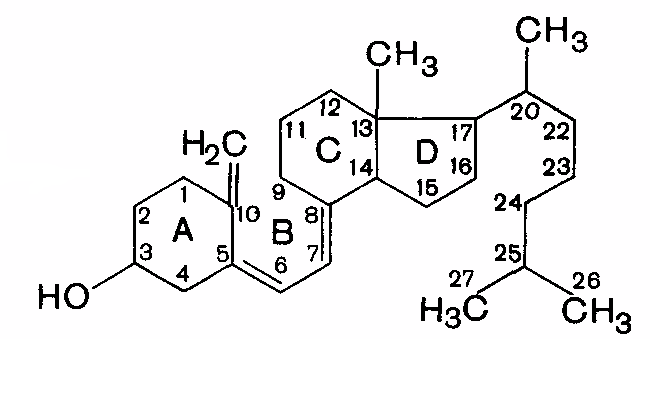
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ Витамин А (ретинол).
Витамин А имеет несколько витамеров. Витамеры– вещества, сходные по химическому строению и обладающие физиологическим действием, характерным для того или иного витамина. Окисляясь в организме при участии биокатализатора, ретинол превращается в ретиналь, также обладающий активностью витамина А. Витамин А влияет на барьерную функцию кожи, слизистых, проницаемость клеточных мембран и биосинтез гликопротеинов, участвует в процессе светоощущения, входя в состав светочувствительного пигмента родопсина. Родопсин состоит из липопротеина опсина и простетической группы, представленной ретиналем. На свету родопсин расщепляется на белок опсин и ретиналь; последний превращается в транс-форму. С этими превращениями связана трансформация энергии световых лучей в зрительное возбуждение. Недостаточность витамина А ведет к торможению роста, снижению массы тела, поражению кожи, слизистых оболочек и глаз (ксерофтальмия, «куриная» (ночная) слепота). Витамин А содержится в печени, яичном желтке, молоке, масле; провитамин А (каротин) - в красномякотных овощах. Суточная потребность – 2,7 мг. У человека основным органом, в котором откладывается про запас витамин А, является печень. Описаны случаи гипервитаминоза А при употреблении в пищу печени белого медведя, тюленя, моржа, в которой содержится много свободного витамина А. Гипервитаминоз может развиться и в результате приема больших количеств рыбьего жира и препаратов витамина А. При гипервитаминозе наблюдаются воспаление глаз, выпадение волос, головные боли, диспепсические расстройства (тошнота, рвота). Витамин D (кальциферол) в организме человека существует в виде форм D2 и D3. Предшественник витамина D2 (эргокальциферола) – эргостерин. Предшественник витамина D3 (холекальциферола) – холестерол. Эргостероли холестеролпереходят в активную форму под действием солнечного облучения.
D2 (эргокальциферол) D3 (холекальциферол) Кальциферолы участвуют в регуляции процессов всасывания кальция и фосфора в кишечнике, в остеогенезе, в синтезе мРНК, Са-связывающих белков и гормонов. Недостаток витамина D в детском возрасте приводит к рахиту. Наблюдаются размягчение костей, их искривление; утолщения на костно-хрящевой границе ребер; большая голова, увеличенный живот (гипотония мышц). Авитаминоз D у взрослых ведет к остеопорозу (вымывание солей из костной ткани, в результате чего кости становятся хрупкими). Гипервитаминоз D наблюдается при приеме очень высоких доз витамина и может привести к смертельному исходу. Наблюдается усиление отложения фосфатов в костях и некоторых внутренних органах. Витамин D содержится в продуктах животного происхождения - сливочном масле, печени, желтке яиц и жире. Суточная потребность – 10 мкг, для детей – 20-25 мкг. Для профилактики рахита в детском возрасте рекомендуется УФ-облучение. Витамин Е (токоферол) (от греч. токос – потомство, феро – несу) получил свое название, т.к. было установлено, что он регулирует процесс размножения у крыс.
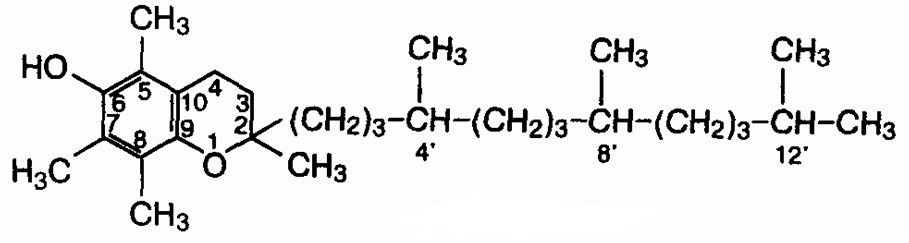
Витамин Е – один из самых сильных природных антиоксидантов. Он защищает полиненасыщенные жирные кислоты и липиды клеточных мембран от окисления. При отсутствии или недостатке витамина Е у человека и животных нарушается эмбриогенез и наблюдаются дегенеративные изменения репродуктивных органов. Развиваются дегенерация спинного мозга и паралич конечностей, жировая инфильтрация печени, мышечная дистрофия, биохимические изменения в мышцах. Источники витамина Е - растительные масла, салат, капуста и зерновые продукты. Витамин Е откладывается в мышцах, поджелудочной железе, жировой ткани, поэтому развитие авитаминоза почти не наблюдается. Суточная потребность – 5 мг. Витамин K (филлохинон).
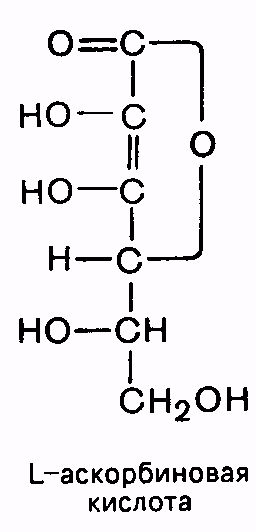
Принимает участие в синтезе факторов свертывания крови. При недостатке его могут возникать самопроизвольные носовые кровотечения, кровавая рвота, внутренние кровоизлияния. Авитаминоз K встречается редко – смешанная пища достаточно богата им; кишечная микрофлора способна синтезировать витамин K. Препарат «Викасол» является производным витамина K3. ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ Витамин С (аскорбиновая кислота) -бесцветные кристаллы, кислые на вкус.
Аскорбиновая кислота является участником окислительно-восстановительных процессов; необходима для синтеза коллагена, гормонов коры надпочечников, триптофана, распада гемоглобина в тканях. При недостаточном поступлении витамина С с пищей отмечается снижение массы тела, слабость, одышка, боли в сердце. В тяжелых случаях развивается цинга. Повышается проницаемость и хрупкость кровеносных сосудов, возникают спонтанные кровоизлияния, расшатываются и выпадают зубы. В основе этих явлений лежат нарушения синтеза коллагена. Источником витамина С для человека служат плоды шиповника, черная смородина, облепиха, рябина, красный перец, лимоны, капуста. Суточная потребность – 75 мг. Витамин B1 (тиамин) - первый кристаллический витамин, полученный в лаборатории. Содержит пиримидиновое и тиазоловое кольца, соединенные метиленовой связью:
Активная форма тиамина – тиаминпирофосфат(ТПФ) (тиаминдифосфат). Он является составной частью 5 ферментов, участвующих в промежуточном обмене веществ.
Симптомы авитаминоза В1: нарушение функций пищеварительного тракта, нарушения психики (галлюцинации), дегенеративные изменения нервных окончаний и проводящих пучков, атрофия и паралич конечностей, угнетение сердечно-сосудистой системы. При B1-авитаминозе развивается заболевание, получившее название полиневрита («бери-бери»), которое может привести к параличу и смерти. Источником витамина B1 являются дрожжи, хлеб из муки грубого помола, когда зерно в процессе обработки не теряет зародышей и оболочек. В животных продуктах содержится в печени, почках, мозге. Суточная потребность 1,2 мг. Витамин В2 (рибофлавин).Основу молекулы рибофлавина составляет изоаллоксазин, в котором сочетаются бензольный, пиразиновый и пиримидиновый циклы:
Способность рибофлавина легко окисляться и восстанавливаться лежит в основе его биологического действия. Рибофлавин является коферментом оксидоредуктаз (входит в состав ФАД и ФМН). При В2-авитаминозе наблюдаются остановка роста, выпадение волос, поражение слизистых оболочек (особенно в уголках рта), быстрая утомляемость зрения, понижение работоспособности, нарушение нормального синтеза гемоглобина; мышечная слабость. Источники витамина В2 - молоко и зеленые овощи; много его в печени и почках животных, в пивных и пекарских дрожжах. Суточная потребность – 1,7 мг. Витамин В6 (пиридоксин)является производным 3-оксипиридина. Представлен пиридоксолом, пиридоксалем и пиридоксамином, каждый из них в организме способен перейти в пиридоксальфосфат. Пиридоксальфосфат является простетической группой аминотрансфераз и карбоксилаз, участвует в образовании биогенных аминов, превращениях аминокислот, синтезе гема гемоглобина. Основные симптомы авитаминоза В6 - нарушение кроветворения, развитие различного рода дерматитов, которые не поддаются лечению никотиновой кислотой, атеросклероз. Источники пиридоксина – говядина, рыба, горох, яичный желток и зеленые части растений. Суточная потребность – 2 мг. Так как витамин В6 широко распространен в продуктах питании и может частично синтезироваться микрофлорой кишечника, то в обычных условиях В6-авитаминоз у человека не наблюдается. Витамин B12 (цианкобаламин).Содержит группировку из 4 восстановленных пиррольных колец с атомом Со+ в центре:
Производные В12 являются коферментами в составе ряда ферментов, ускоряющих важнейшие реакции азотистого, углеводного, нуклеинового и липидного обмена. В12 участвует в реакциях трансметилирования, во внутримолекулярном переносе атомов Н и различных химических групп (гидроксильные, аминогруппы и др.). Недостаток витамина B12 ведет к нарушению нормального кроветворения в костном мозгу, вызывает злокачественную мегабластическую анемию, нарушение деятельности нервной системы, снижение кислотности желудочного сока. Витамин В12 – единственный витамин, синтез которого осуществляется только микроорганизмами. Источники кобаламина: мясо, говяжья печень, рыба, молоко, яйца. Растения не содержат витамина B12. Депо витамина B12 у человека находится в печени, где он накапливается в количестве нескольких миллиграммов. Суточная потребность – 3 мкг. Витамин В5 (пантотеновая кислота)- содержится во всех животных, растительных и микробных объектах (греч. panthos - везде).
Пантотеновая кислота входит в состав коэнзима А. KоА принимает участие в реакциях переноса ацильных групп, с ним связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. При отсутствии витамина В5 возникают дерматиты, замедляется рост, наблюдается потеря веса, выпадение и депигментация волос, дегенеративные изменения в нервной системе. С этим связаны дискоординация движений, парличи, нарушение работы желудочно-кишечного тракта, органов размножения, надпочечников. У человека авитаминоз В5 редок, так как пантотеновая кислота вырабатывается кишечной микрофлорой. Источниками пантотеновой кислоты являются дрожжи, молоко, яйца, печень, почки, горох, цветная капуста, картофель, помидоры. Суточная потребность - 10 мг. Витамин РР (никотинамид и никотиновая кислота, ниацин, В3) - производное пиридина:
Витамин РР участвует во всех видах обмена веществ: углеводном, белковом и липидном. Никотинамид входит в состав важнейших коферментов дегидрогеназ – НАД+ (никотинамидадениндинуклеотид)и НАДФ+ (никотинамидадениндинуклеотидфосфат), участвующих в окислительно-восстановительных реакциях. Витамин РР имеет решающее значение для выработки энергии. При дефиците витамина РР возникает заболевание пеллагра. Авитаминоз РР выражается в воспалении слизистых оболочек желудочно-кишечного тракта, а затем - в воспалении кожи (дерматитах) на участках тела, подверженных освещению солнцем. Наблюдаются также поражения мозга. Источники витамина РР - гречка, хлеб, картофель, фасоль, печень и почки животных и др. Некоторое количество никотиновой кислоты синтезируется в организме человека из аминокислоты триптофана. Суточная потребность – 18 мг. Фолиевая кислота, витамин Вс (птероилглутаминовая кислота).
Человек редко страдает от Вс-авитаминоза, так как фолиевая кислота синтезируется микрофлорой желудочно-кишечного тракта и всегда поступает в организм в достаточном количестве. При авитамитозе Вс развивается анемия и нарушается деятельность органов пищеварения. Фолиевая кислота, являясь коферментом ряда ферментов, переносит одноуглеродные фрагменты при биосинтезе многих соединений: метильную группу, оксиметильную (-СН2ОН), формильную. Источниками фолиевых кислот являются шпинат, цветная капуста, печень животных, хлеб. Особенно высоко ее содержание в дрожжах. Витамин Р (рутин).В настоящее время известно много соединений, обладающих Р-витаминным действием. Их называют биофлавоноидами.
При отсутствии витамина Р повышается проницаемость капилляров, что сопровождается кровоизлияниями, болью в конечностях, общей слабостью и быстрой утомляемостью. Предполагают, что витамины группы Р участвуют в окислительно-восстановительных реакциях. Источником витамина Р являются те же продукты, в которых много витамина С, например черная смородина и лимоны. Витамин Н (биотин).
При недостатке этого витамина у человека наблюдается воспаление кожных покровов, выпадение волос, усиленное выделение жира сальными железами кожи (себоррея). В качестве кофермента биотин входит в состав ферментов, ускоряющих реакции карбоксилирования. Источником витамина Н являются печень и почки крупного рогатого скота, куриные яйца, молоко, томаты, соя, морковь, картофель, горох. Возможно также поступление биотина в организм за счет микробов-симбионтов. Витаминоподобные вещества. Помимо двух главных групп витаминов, выделяют группу разнообразных химических веществ, из которых часть синтезируется в организме и обладает витаминными свойствами. К ним относят холин, липоевую кислоту, витамин В15, парааминобензойную кислоту, карнитин, линолевую и линоленовую кислоты, витамин U и др. Антивитамины- это соединения, похожие по структуре на витамины, конкурирующие с витаминами в соответствующих биохимических процессах или выключающие витамины из процессов обмена веществ путем их разрушения или связывания. Примером конкурирующих антивитаминовмогут служить структурные аналоги витамина РР. Они способны образовывать псевдо-коферменты, имитирующие НАД+ и блокирующие деятельность НАД+-зависимых оксидоредуктаз. Примером выключающих антивитаминов является авидин - яичный белок, образующий с витамином Н нерастворимый биологически неактивный комплекс. Поскольку бактерии и вирусы, а также клетки опухолей обладают повышенной чувствительностью к отсутствию ряда витаминов, антивитамины используют как терапевтические средства. |
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 218. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 Г + Н3РО4
Г + Н3РО4