
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВДля определения аминокислот, входящих в состав белков, применяют кислотный (НС1), щелочной (Ва(ОН)2) и ферментативный гидролиз. При гидролизе чистого белка, не содержащего примесей, освобождаются 20 различных аминокислот. Аминокислоты, входящие в состав белков, являются Аминокислоты отличаются друг от друга химической природой радикала R, который не участвует в образовании пептидной связи. Современная классификация аминокислот базируется на полярности радикалов. Выделяют следующие классы: Неполярные (гидрофобные) аминокислоты
Полярные (гидрофильные) аминокислоты
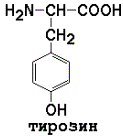
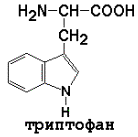
Ароматические (в основном неполярные) аминокислоты
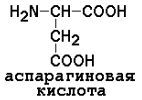
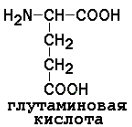
Отрицательно заряженные аминокислоты
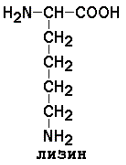
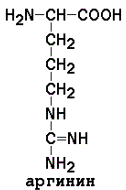
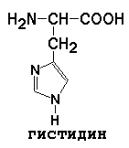
Положительно заряженные аминокислоты
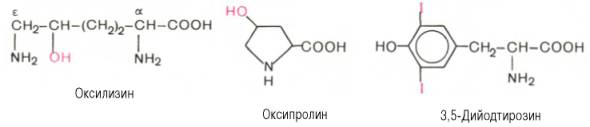
В некоторых белках содержатся специфические производные аминокислот. В коллагене (белке соединительной ткани) обнаружены оксипролин и оксилизин. Основой структуры гормонов щитовидной железы является дийодтирозин – производное тирозина.
Общим свойством аминокислот является амфотерность (от греч amphoteros - двусторонний). В интервале рН 4,0-9,0 почти все аминокислоты существуют в форме биполяных ионов (цвиттерионов). Значение изоэлектрической точки аминокислоты (ИЭТ, рI) рассчитывается по формуле: 
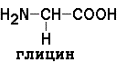
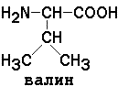
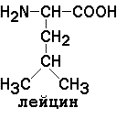
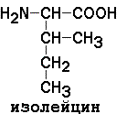
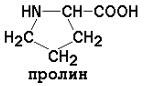
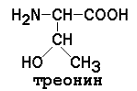
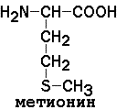
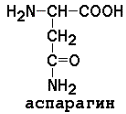
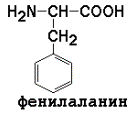
рI для моноаминодикарбоновых кислот рассчитывается как полусумма значений рK (таблица 1) a- и w-карбоксильных групп, для диаминомонокарбоновых кислот – как полусумма значений рK a- и w-аминогрупп. Существуют заменимые аминокислоты, которые могут быть синтезированы в организме человека, и незаменимые, которые в организме не образуются и должны поступать в составе пищи. Незаменимые аминокислоты: валин, треонин, лейцин, лизин, метионин, триптофан, изолейцин, фенилаланин. Заменимые аминокислоты: глицин, аланин, аспартат, аспарагин, глутамат, глутамин, серин, пролин. Условно заменимые аминокислоты (могут синтезироваться в организме из других аминокислот): аргинин (из цитруллина), цистеин (из серина), тирозин (из фенилаланина), гистидин (при участии глутамина). Относительное содержание различных аминокислот в белках неодинаково. Для обнаружения аминокислот в биологических объектах и их количественного определения используют реакцию с нингидрином.
Таблица 1. Константы диссоциации аминокислот
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 215. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
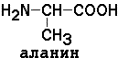
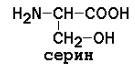
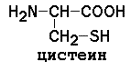

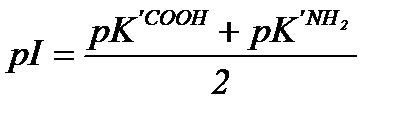 .
.