
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Парниковые газы и их свойстваКак уже отмечалось выше, в земной атмосферепарниковый эффект обусловлен присутствием в ней таких газов, как водяной пар, диоксид углерода, метан, озон, закись азота и фреоны. Свойства озона и закиси азота были рассмотрены в предыдущих лекциях. Особенности фреонов, образуемых в основном техногенными источниками, будут рассмотрены в дисциплине «Техно и урбоэкология». Свойствам водяного пара будет посвящена отдельная лекция. Тем не менее, здесь отметим, что этот газ вносит основной вклад в парниковый эффект земной атмосферы. Основная часть водяного пара содержится в тропосфере, где его концентрация существенно зависит от приповерхностной температуры. Диоксид углерода Второе место по своему влиянию на парниковый эффект занимает углекислый газ CO2 (диоксид углерода, двуокись углерода, угольный ангидрид, углекислота). На его долю ныне приходится парниковый эффект приблизительно равный 7оС. CO2, - газ, без цвета и запаха, со слегка кисловатым вкусом. Его плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения. CO2 легко пропускает солнечную радиацию ультрафиолетового и видимого диапазона. В то же время он поглощает инфракрасное излучение в диапазоне от 12 до 17 мкм, что и определяет его свойства как парникового газа. Постоянный рост концентрации этого газа в атмосфере наблюдается с начала индустриальной эпохи. Ныне она достигла 0,038 %. Поэтому, по мнению Международной группы экспертов по проблемам изменений климата и многих других авторов, именно это вещество играет основную роль в современном потеплении климата. Как одно из подтверждений этого, они приводят следующую таблицу 
Таблица 2. Парциальное давление СО2 и парниковый эффект в атмосферах ряда планет.
Из таблицы 2 видно, что содержание в атмосфере планеты СО2 и проявляющийся в ней парниковый эффект взаимосвязаны. В этом смысле Земля занимает промежуточное положение между Венерой и Марсом. Установлено, что содержание СО2 в земной атмосфере в прошлом существенно изменялось, в соответствии с изменениями глобальной температуры земной атмосферы. Концентрации СО2 в воздухе были максимальны и равны 0.061% в меловом периоде, когда средняя температура океанических вод достигала +17 °С (291 К). Наиболее изменчивыми стали и температуры воздуха и концентрации СО2 в позднем плейстоцене – голоцене. Особенности этих изменений приведены на рисунке 3.
Рис.3. Изменения концентраций в воздухе СО2, а также средних температур в приземном слое земной атмосферы в позднем плейстоцене- голоцене. Из рисунка 3, видно, что на протяжении последних 420 тыс. лет преобладали тенденции к похолоданию климата и уменьшению средних содержаний в воздухе СО2. При этом имели место колебания температуры между ледниковыми и межледниковыми эпохами, достигавшие 10 °С. Концентрации СО2 также изменялись от 0.018 до 0.038%. Очевидно соответствие между обеими зависимостями. По мнению Сорохтина О.А. максимумы концентраций СО2 наступали раньше, чем максимумы температур приблизительно на 600 лет. Причиной этого является закон Генри, согласно которому растворимость в воде СО2 , тем меньше, чем выше ее температура. По мнению других авторов подобного опережения нет, хотя нет и отставания. Поэтому, учитывая выводы теории Кондратьева, можно заключить, что происходящая ныне в мире борьба с техногенными выбросами в атмосферу СО2 способна лишь частично решить проблему глобального потепления климата. По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. В живой природе СО2 играет существенную роль, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Растения поглощают углекислый газ в процессе фотосинтеза, а при дыхании и без освещения они тоже его выделяют. Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье. Недостаток углекислого газа тоже опасен, поскольку углекислый газ в организмах животных участвует во многих физиологических процессах, например, обмене веществ и регуляции сосудистого тонуса. Метан На третьем месте по своему влиянию на парниковый эффект стоит метан СН4 — простейший углеводород, бесцветный газ без запаха. Он малорастворим в воде, легче воздуха и не опасен для здоровья человека (если не считать того, что не поддерживает дыхания и взрывоопасен при концентрации в воздухе от 5 % до 15 %). ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3. СН4 горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом он образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания метана -184о С (при нормальном давлении). При равных концентрациях в воздухе метан создает парниковый эффект в 21 раз более сильный, чем СО2. В воздухе метан вступает с галогенами в реакции замещения (например, CH4 + 3Cl2= CHCl3+ 3HCl), которые проходят по свободно радикальному механизму: CH4 + ½Cl2 = CH3Cl (хлорметан) CH3Cl + ½Cl2 = CH2Cl2 (дихлорметан) CH2Cl2 + ½Cl2 = CHCl3 (трихлорметан) CHCl3 + ½Cl2 = CCl4 (тетрахлорметан) Метан — первый член гомологического ряда насыщенных углеводородов, наиболее устойчив к химическим воздействиям. Он основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) метан образуется биогенно. Основными биогенными источниками метана являются пищеварительная ферментация у скота, рисоводство, горение биомассы (в т. ч. пожары в лесах, степях и на торфянниках), термиты, а также листья тропических растений. Некоторый вклад в поступление метана в атмосферу дают утечки при разработке месторождений каменного угля и природного газа, а также эмиссия в составе биогаза, образующегося на полигонах захоронения отходов. Распределение метана по различным его источникам приведено на рисунке 4.
Рисунок 4. Структура выбросов в атмосферу метана. Как видим из рис. 4, метан с поверхности океана и заснеженных территорий не образуется. Поэтому над регионами умеренных широт его концентрации в воздухе летом больше чем зимой. Над тропическими регионами наоборот, так как бактерии-метаногены обитают лишь во влажной среде (летом тропические болота пересыхают). Установлено, что содержание метана в воздухе в прошлом существенно изменялось. С начала нашей эры в атмосфере преобладает тенденция к увеличению его содержания. Ныне в атмосфере Земли больше метана, чем в любое время за последние 400000 лет. В первом тысячелетии нашей эры концентрации метана возрастали, в результате выжигания лесов, а также развития земледелия и скотоводства. С 1000 по 1700 годы концентрация метана упала на 40 %, но в последующие столетия снова стала расти (предположительно в результате увеличения пахотных земель, пастбищ и выжигания лесов, использования древесины для отопления, увеличения поголовья домашнего скота, количества нечистот, выращивания риса). С 1750 года средняя глобальная атмосферная концентрация метана возросла на 150 процентов от приблизительно 700 до 1745 частей на миллиард по объему (ppbv) в 1998 году. В конце 1970-х годах темпы роста составляли около 20 ppbv в год. В 1980-х годов рост замедлился до 9-13 ppbv в год. В период с 1990 по 1998 наблюдался рост между 0 и 13 ppbv в год. В период после 1999 года концентрация метана остается приблизительно постоянной и равной 1751 ppbv. Баланс между выбросами метана и процессами его удаления в конечном итоге определяет концентрации и время пребывания метана в атмосфере - примерно 12 лет. В тропосфере метан практически не окисляется. Его реакции с атомарным хлором и радикалами ОН протекают в стратосфере, вследствие чего здесь его концентрации в воздухе быстро снижаются. Доминирующим процессом удаления метана из атмосферы является его окисление гидроксильными радикалами (ОН). Метан начинает реагировать с ОН в тропосфере, производя СН3 и воду. В основном этот процесс протекает в стратосфере, где ОН образуются при фотолизе воды и в других реакциях. На эти реакции с ОН приходится около 90% удаления метана из атмосферы. Кроме реакции с ОН уменьшение концентраций в воздухе метана происходит в результате его микробиологического поглощения в почвах и реакции с атомами хлора (Cl)в стратосфере, а также на поверхности моря. Вклад этих процессов 7% и менее 2% соответственно. Поэтому зависимости от высоты над уровнем моря количеств молекул метана, радикалов ОН и атомарного кислорода, содержащихся в 1 см3 воздуха имеют вид, приведенный на следующем рисунке 5.
Рисунок 5. Зависимости от высоты над уровнем моря количества молекул в 1 см3 (А) и объемных концентраций в воздухе (Б) метана атомарного кислорода и других веществ.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 219. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 , атм.
, атм.
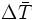 оС
оС



