
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Химические свойства аминокислот.Стр 1 из 2Следующая ⇒ Изомеры и гомологи. Изомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы. Широко распространены также названия аминокислот, в которых положения аминогруппы обозначаются буквами греческого алфавита. Так, 2-аминобутановую кислоту можно назвать также α-аминомасляной кислотой:
NH2 –CH2 –COOH NH2 –CH2 –CH2 –COOH аминоуксусная кислота β-аминопропиновая кислота CH3-CH-COOH | NH2 α-аминопропиновая кислота Разделяют α−и β-аминокислоты:
В природе встречаются в основном α-кислоты. В состав белков входят 19 аминокислот и одна аминокислота (С5Н9NO2):
Межклассовыми изомерами для аминокислот являются нитросоединения R—NO2.
Аминокислоты обладают оптической активностью, так как содержат атомы углерода (асимметрические атомы), связанные с четырьмя различными заместителями (исключение составляет аминоуксусная кислота − глицин), и могут существовать в виде 2-х изомеров (энантиомеров), физические и химические свойства которых одинаковы, за исключением одного − способности вращать плоскость поляризованного луча в противоположные стороны. Направление вращения плоскости поляризации обозначается знаком (+) − правое вращение, (-) − левое вращение.  Различают D-аминокислоты и L-аминокислоты. Расположение аминогруппы NH2 в проекционной формуле слева соответствует L-конфигурации, а справа − D-конфигурации. Знак вращения не связан с принадлежностью соединения к L- или D-ряду. Так, L-ceрин имеет знак вращения (−), а L-аланин − (+).
3. Получение α-аминокислот. 1. Из карбоновых кислот (заместив в их радикале атом водорода на галоген, а затем на аминогруппу при взаимодействии с аммиаком): CH3—CH2—COOH + Cl2 → CH3—CHCl—COOH + HCl H —CHCl—COOH + 3NH3 → CH3—CH(NH2)—COONH4 + NH4Cl CH3—CH(NH2)—COONH4 + HCl → CH3—CH(NH2)—COOH + NH4Cl 2. Кислотный гидролиз белков (обычно получают смесь аминокислот). Свойства аминокислот. Физические свойства аминокислот. Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200°С. Они растворимы в воде и мало растворимые в неполярных растворителях (например, нерастворимы в эфире). В зависимости от состава радикала R− они могут быть сладкими, горькими или безвкусными. Химические свойства аминокислот. 1. Горение: 4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2 2. Взаимодействие с водой: NH2CH2COOH + H2O NH2CH2COOH + H2O (NH2CH2COOH Т.е. кислотно-основные превращение можно представить в виде:
Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная. Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода. 3. Группа −СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Реакции с растворами щелочей: NH2CH2COOH + NaOH → NH2CH2COO−Na + H2O аминоацетат натрия 4. Реагируют как кислоты со спиртами в присутствие газообразного HCl (реакция этерификация): NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O 5. Аминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота. Реакции с растворами кислот 2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4 сульфат глициния 6. Конденсация: а) димеризация NH2−(CH2)5−COOH + H−NH−(CH2)5−COOH →H2N−(CH2)5−CO−NH−(CH2)5−COOH+H2O аминокапроновая (6-аминогексановая) кислота димер (дипептид) б) поликонденсация nNH2−(CH2)5−COOH → [−NH−(CH2)5−COO−]n + (n − 1)H2O аминокапроновая кислота капрон Группа −CO−NH− называется амидной группой (пептидная группа, связь (−C−N−) − пептидной связью, а образующиеся полимеры – полиамидами (полимеры α−аминокислот − полипептидами). В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды. К полипептидам относятся белки. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь α−аминокислот. |
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 683. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||


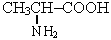 2-аминопропановая кислота
2-аминопропановая кислота
 -аминопропановая кислота (аланин)
-аминопропановая кислота (аланин)
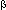 -аминопропановая кислота
-аминопропановая кислота
 2-аминобутановая кислота
2-аминобутановая кислота
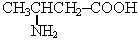
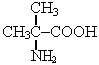 2-амино-2-метилпропановая кислота
2-амино-2-метилпропановая кислота

 +NH3CH2COOH + OH−
+NH3CH2COOH + OH−