
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ⇐ ПредыдущаяСтр 2 из 2 СНИЖЕНИЕ ОЖСС (ПОВЫШЕНИЕ СЫВОРОТОЧНОГО ЖЕЛЕЗА) Ø при хронических инфекциях; Ø злокачественных новообразованиях; Ø при отравлении железом; Ø заболеваниях почек; Ø нефрозе; Ø квашиоркоре и талассемии; Ø повышенное поступление в организм: гемохроматоз, избыточное парентеральное введение препаратов железа, повторные гемотрансфузии, острое отравление препаратами железа у детей; Ø анемии: гемолитические анемии, гипо- и апластические анемии, витамин В12- (В6-) – и фолиеводефицитные и гиперхромные анемии; Ø хронический холецистит; Ø применение таких лекарственных средств, как хлорамфеникол (левомицетин), эстрогены, метотрексат.
ПОВЫШЕНИЕ ОЖСС (СНИЖЕНИЕ СЫВОРОТОЧНОГО ЖЕЛЕЗА) Ø при железодефицитной анемии; Ø на поздних сроках беременности; Ø при оральной контрацепции; Ø недостаточное поступление железа в организм (молочно-растительная диета, заболевания желудка и кишечника); Ø ремиссия пернициозной анемии (авитаминоз В12); Ø гипотиреоз; Ø нефротический синдром; Ø хронические заболевания печени (гепатит, цирроз); Ø прием аллопуринола, андрогенов, аспирина, холестирамина, глюкокортикоидов.
Лекция №16. Содержание темы: 1. Представление об осмотическом, коллоидно-осмотическом давлении крови. 2. Буферные системы в плазме крови. 3. Регуляция кислотно-основного состояния физиологическими системами организма. 4. Алкалозы и ацидозы, причины развития, КДЗ исследования КОС (кислотно-основное состояние).
Осмотическое давление создается белками плазмы, а также растворенными в плазме крови кристаллоидами. Осмотическое давление, обусловленное белками плазмы, называется ОНКОТИЧЕСКИМ.  ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ играет важную роль в обмене воды между кровью и тканями. Крупные молекулы белков плазмы не проходят через эндотелиальную стенку капилляров. Оставаясь внутри кровеносного русла, они удерживают в крови некоторое количество воды. ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ – коллоидно-осмотическое давление, доля осмотического давления, создаваемая высоко-молекулярными компонентами раствора. Скорость фильтрации жидкости через стенку капилляра определяется разницей между онкотическим давлением белков плазмы и гидростатическим давлением крови, создаваемым работой сердца. При заболеваниях, сопровождающихся уменьшением концентрации в крови белков (особенно альбуминов), онкотическое давление снижается, и это может явиться одной из причин накопления жидкости в межклеточном пространстве, в результате чего развиваются отеки. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ – избыточное гидростатическое давление на раствор, отделенный от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уровнять концентрации обоих растворов вследствие встречной диффузии молекул растворенного вещества и растворителя. Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделенных полупроницаемой мембраной, называется тоничностью.Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором называется гипертоническим, имеющий более низкое – гипотоническим.
Вопросы для учащихся (использование межпредметных связей с аналитичес-кой химией): 1. Как диссоциирует H2O? 2. Какие растворы называют нейтральными? 3. какие растворы называют щелочными или основными? 4. Что такое буферные растворы? 5. Назовите типы буферных растворов. 6. Какую роль играют буферные растворы? 7. Когда происходит изменение pH крови, желчи? Под термином «кислотно-основное состояние» (КОС) принято понимать комплекс физико-химических, физиологических и иных регуляторных механизмов, поддерживающих постоянство активной реакции крови или с современных позиций правильнее говорить о регуляции реакции жидкостей организма. Эта реакция характеризуется концентрацией водородных ионов [H+]. Ионы водорода создают кислую реакцию среды, а щелочную реакцию обуславливают гидроксид-ионы и другие компоненты биологических жидкостей. Таким образом, КОС – это соотношение [H+] и [OH-] в биологических средах. Между [H+] и [OH-] в любых биологических жидкостях существует обратно-пропорциональная зависимость. Концентрация данных ионов может меняться от 10-1 до 10-14 моль/л. Если [H+] превышает концентрацию [OH-], то реакция среды кислая, и наоборот, если [OH-] превышает [H+], то реакция щелочная. У здорового человека основные компоненты преобладают над кислыми, в связи с чем реакция крови слабощелочная (pH = 7,35-7,45). Слабоосновной характер реакции плазмы обусловлен содержанием в ней анионов HCO3‾, HPO42‾, Prot‾n (компонентов гидрокарбонатной, фосфатной и протеинатной, или белковой, буферных систем), обладающих свойством связывать ионы водорода и тем самым вызывать их относительный дефицит. Одним из необходимых условий жизнедеятельности организма является постоянство реакций внутренней среды, которая определяется соотношением кислот и оснований, непрерывно образующихся в процессе метаболизма. Кислота – это молекула или ион, отдающие протон, а основание – молекула или ион, присоединяющие протон. Значительное количество ионов водорода высвобождается в ходе реакций распада белков, жиров и углеводов. Одновременно с ионами водорода накапливаются и основные соединения, которые уравновешивают общую реакцию среды. Пределы изменения величины pH крови, совместимые с жизнью, составляют ± 0,4 единицы от среднего значения 7,4. Даже незначительные колебания pH в ту или другую сторону могут иметь тяжёлые последствия. При этом угнетается активность многих ферментов, нарушается деятельность центральной нервной системы, сердечно-сосудистой системы. В крови имеется четыре буферные системы: бикарбонатная (гидрокарбонатная), фосфатная, белковая (протеинатная) и гемоглобиновая. Эти системы и представляют собой физико-химические механизмы поддержания постоянства pH. Значение pH определяет степень диссоциации веществ и ферментов, что оказывает влияние на конформацию молекул в клетках и их функции. Изменения pH оказывают влияние на процессы ионного обмена через мембраны и, в первую очередь, на перенос ионов калия. Учитывая тесную связь между вне- и внутриклеточным пространствами, регуляция pH во внеклеточном пространстве оказывает влияние на внутриклеточные процессы. Обычно в норме pH внеклеточной жидкости находится в пределах 7,4, а внутриклеточной – в пределах 6,9. В процессе обмена веществ чаще образуются кислые продукты. За довольно короткий промежуток времени может возникнуть большое количество протонов. Среди кислых продуктов следует назвать угольную кислоту, фосфорную кислоту и серную кислоту, образующуюся при распаде аминокислот. Из органических кислот, кроме кетоновых кислот, можно назвать молочную и др. Поэтому основную опасность в изменениях pH можно ожидать со стороны кислот. Наиболее активной буферной системой внеклеточного пространства является бикарбонатная буферная система.Изменяя концентрацию бикарбоната в плазме и парциальное давление CO2, можно смещать pH в ту или иную сторону. Поскольку же выделение CO2 тесно связано с функцией лёгких, а изменение концентрации HCO3‾ - с функцией почек, при заболеваниях этих жизненно важных органов часто и происходят более или менее выраженные смещения pH. Буферная ёмкость гидрокарбонатной системы составляет 7-9% всей буферной ёмкости крови. Эта система является чувствительным индикатором КЩС, а определение компонентов широко используют для диагностики его расстройств (например, острые кишечные инфекции). Гемоглобиновая буферная система крови. При насыщении кислородом гемоглобин отдаёт протоны, и, наоборот, при отдаче кислорода гемоглобин связывает протоны. Это свойство гемоглобина имеет большое значение для транспорта CO2. Фосфатная буферная системаиграет большую роль в почечной регуляции КЩС, а также внутри клеток различных органов. Роль фосфатного буфера сводится к восстановлению гидрокарбонатов в обменной реакции:
H2CO3 + Na2HPO4 ↔ NaHCO3 + NaH2PO4.
При этом устраняется избыток H2CO3 в плазме и восстанавливается постоянство соотношения: [H+] = Существенное значение для постоянства pH имеют гексозофосфаты, триозофосфаты, нуклеозидфосфаты (адениловая кислота) и некоторые другие соединения фосфорной кислоты. Своими фосфорными остатками они могут соединяться с различными катионами и тем самым способствовать поддержанию постоянства слабощелочной реакции крови и других тканей. Продукты, образовавшиеся в ходе реакций, выделяются через лёгкие (CO2) и с мочой (например, NaH2PO4). Белковая буферная системаобразована белками плазмы крови. При слабощелочной реакции крови белки проявляют свойства слабых кислот и диссоциируют по схеме:
OH O , |
|||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 222. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
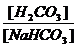 =
=  = const.
= const.


