Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
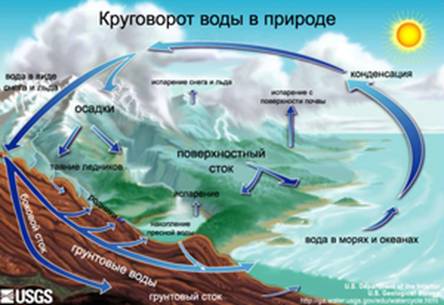
Влияние растворенных веществ на структуру водыКруговорот воды в природе Постоянный обмен влагой между гидросферой, атмосферой и земной поверхностью, состоящий из процессов испарения, передвижения водяного пара в атмосфере, его конденсации в атмосфере, выпадения осадков и стока, получил название круговорота воды в природе.Его схема показана на рисунке 1 Обмен веществами между атмосферой и подстилающей поверхностью в круговороте воды в природе обеспечивается в основном процессами испарения, сублимации, конденсации, кристаллизации, а также выпадения атмосферных осадков. В атмосферу вода поступает в основном в виде водяного пара в результате испарения с поверхности гидросферы (Мирового океана и водных объектов суши).
Рисунок 1. Схема круговорота воды в природе
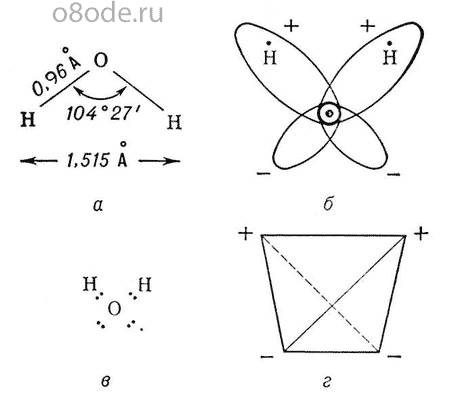
С поверхности Мирового океана за год испаряется около 450 тысяч кубических километров воды. Если бы ее распределить по его поверхности, образовался бы слой толщиной около 1, 25м. Значимый вклад вносит также испарение ее почвой и наземной растительностью (транспирация), а также криосферой. В целом, с материков в атмосферу поступает 71 тысяча кубических километров воды. Моря теряют из-за испарения больше воды, чем получают с осадками, на суше — положение обратное. Значительные количества водяного пара выбрасываются из недр Земли при извержениях вулканов, а также проникают в атмосферу из космоса. Всего за год в атмосферу поступает в среднем примерно 521 тысяча кубических километров воды (это примерно семь таких водоемов как Каспийское море). Такое же количество воды ежегодно возвращается на земную поверхность из атмосферы, увлажняя почву и создавая условия для развития флоры и фауны во внутренних регионах материков, лишенных собственных источников влаги.Атмосферные осадки частично испаряются, частично образуют временные и постоянные водостоки и водоемы, частично — просачиваются в землю и образуют подземные воды.  Различают несколько видов круговоротов воды в природе: Большой, или мировой, круговорот — водяной пар, образовавшийся над поверхностью океанов, переносится ветрами на материки, выпадает там в виде атмосферных осадков и возвращается в океан в виде стока. В этом процессе изменяется качество воды: при испарении соленая морская вода превращается в пресную, а загрязненная — очищается. Малый, или океанический, круговорот — водяной пар, образовавшийся над поверхностью океана, конденсируется и выпадает в виде осадков снова в океан. Внутриконтинентальныйкруговорот — вода, которая испарилась над поверхностью суши, опять выпадают на сушу в виде атмосферных осадков, которые образуют сток и достигают Мирового океана. Скорость Среднее время очистки Среднее время обновления Океаны 200 лет Ледники от 20 до 100 лет Сезонный снежный покров от 2 до 6 месяцев Почвенная корка от 1 до 2 месяцев Грунтовые воды: паводок от 100 до 200 лет Грунтовые воды: углубленные 10 000 лет Озера от 50 до 100 лет Реки от 2 до 6 месяцев Атмосфера 9 дней Скорость переноса различных видов воды изменяется в широких пределах, периоды их обновления также разные. Они изменяются от нескольких часов до нескольких десятков тысячелетий. Запасы почвенной влаги имеют примерно годичный период накопления и расходов. Атмосферная влага, которая образуется при испарении воды из океанов, морей и суши и существует в виде облаков, обновляется в среднем через девять дней. Воды, входящих в состав живых организмов, восстанавливаются в течение нескольких часов. Период обновления запасов воды в горных ледниках составляет около 1600 лет, в ледниках Антарктиды и Гренландии — около 9 700 лет. Полное обновление вод Мирового океана происходит примерно через 2700 лет. Вода в атмосфере Земли присутствует во всех четырех агрегатных состояниях. Это: - водяной пар (газообразная вода); - капельножидкая вода, образующая жидкие атмосферные осадки, водяные и смешанные облака, а также туманы; - кристаллическая (твердая) вода, входящая в состав твердых атмосферных осадков, ледяных и смешанных облаков, а также туманов; - плазма (ионизированные и диссоциированные молекулы воды- преимущественно гидроксилы ОН). Свойства воды До середины ХVIII века вода считалась неделимым веществом. И только в 1783 году французский химик Антуан Лоран Лавуазье пришел к выводу, что она имеет сложное строение: в ее состав входят водород и кислород. После этого свыше ста лет все считали, что вода — простейшее соединение, описываемое единственно возможной формулой H2O. В Х1Х веке этим представлениям пришел конец, так как были открыты свойства воды, отличающие ее от всех прочих жидкостей. 1. При замерзании вода увеличивает почти на 10% свой объем. Поэтому лед на воде плавает, а водоемы даже самой суровой зимой не промерзают до самого дна, сохраняя в своих глубинах условия для поддержания жизни. 2. Зависимости плотности, сжимаемости и теплоемкости жидкой воды от температуры немонотонны. При нагревании воды от температуры плавления указанные характеристики вначале увеличиваются и лишь после достижения некоторой температуры начинают (как и у прочих жидкостей) уменьшаться. В результате, зимой, при замерзании водоемов в придонном слое вода имеет температуру максимальной плотности (которая существенно выше температуры замерзания). Последнее, делает условия выживания в придонном слое водоемов не просто «сносными», а и относительно «комфортными». 3. Вода имеет в самые высокие среди всех жидкостей (кроме жидкого аммиака) средние значения удельной теплоемкости, теплоты кристаллизации и теплоты парообразования. 4. Вода имеет неизвестные точно и непрерывно изменяющиеся значения своих теплофизических констант. 5. При температуре ниже 30°C с увеличением давления от атмосферного до 0,2 ГПа вязкость воды уменьшается. 6. Вода способна хранить информацию об оказываемых на нее внешних воздействиях. 7. Вода имеет аномально высокое поверхностное натяжение, что не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту. Ученым давно были известны перечисленные и прочие 59 необъяснимых свойств воды, отличающие её от большинства других химических веществ, встречающихся в жидком состоянии. Объяснить эти свойства на основании лишь строения и химических параметров молекул воды ученые до последнего времени не могли, вследствие чего их называют аномальными. Ныне установлено, что их наличию вода обязана особенностям своего молекулярного строения. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода “оголяются”. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. В результате этого молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов в молекуле воды , то получится объемная геометрическая фигура – почти правильный тетраэдр. Угол НОН в молекуле жидкой воды составляет 104о27`, а не 109,5о как в правильном тетраэдре. Расстояние между атомами водорода составляет 0.000000000015м. Расстояние между каждым из атомов водорода и атомом кислорода – в газообразном состоянии и жидкой фазе 0.0000000000096м (0.96А), во льду- 0.0000000000099 (0.99А). Расстояние между атомом кислорода и центром инерции молекулы 0.0000000000013м. (0.13А)
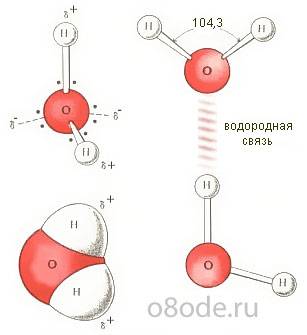
Рисунок 2. Строение молекулы воды Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Однако, в жидком состоянии вода – неупорядоченная жидкость; эти водородные связи - спонтанные, короткоживущие, быстро рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды. Уже в конце XIX века, после того как перечисленные аномальные свойства воды и строение ее молекулы были изучены, возникло предположение, что на самом деле она не единая жидкость, а смесь как минимум двух компонентов, с различными свойствами. Первым подобную идею выдвинул Уайтинг в 1884 году. В 1891 году В. Ренгтен ввёл представление о двух состояниях воды, которые различаются плотностью. После неё появилось множество работ, в которых воду рассматривали как смесь ассоциатов разного состава (“гидролей”).
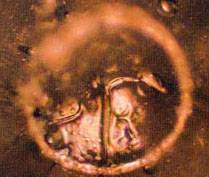
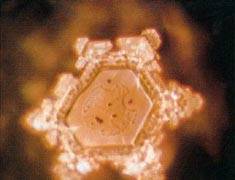
Рисунок 3 Водородные связи между молекулами воды Когда в 20-е годы определили структуру льда, оказалось, что молекулы воды в кристаллическом состоянии образуют трёхмерную непрерывную сетку, в которой каждая молекула имеет четырёх ближайших соседей, расположенных в вершинах правильного тетраэдра. В 1933 году Дж. Бернал и П. Фаулер предположили, что подобная сетка существует и в жидкой воде. Поскольку вода плотнее льда, они считали, что молекулы в ней расположены не так, как во льду, то есть подобно атомам кремния в минерале тридимите, а так, как атомы кремния в более плотной модификации кремнезёма — кварце. Увеличение плотности воды при нагревании от 0 до 4°C объяснялось присутствием при низкой температуре тридимитовой компоненты. Таким образом, модель Бернала — Фаулера сохранила элемент двухструктурности, но главное их достижение — идея непрерывной тетраэдрическои сетки. Тогда появился знаменитый афоризм И. Ленгмюра: „Океан — одна большая молекула“. Только в 1951 году Дж. Попл создал модель структуры воды, как непрерывной случайной тетраэдрической сетки, связи между молекулами в которой искривлены и имеют различную длину. Модель Попла объясняет уплотнение воды при плавлении искривлением связей. В тоже время она не объясняет немонотонность зависимости свойств воды от температуры и давления так хорошо, как модели двух состояний. В 60-70-е годы ХХ века возникли еще две группы „смешанных“ моделей структуры воды: кластерные и клатратные. В кластерных моделях структура воды рассматривалась как совокупность не связанных между собой кластеров, молекулярных агрегатов, состоящих из молекул, связанных водородными связями, которые плавали в море молекул, в таких связях не участвующих. Среди подобных моделей наиболее яркой оказалась модель Г. Немети и Х. Шераги: предполагающие, что кластеры связанных молекул, плавают в море несвязанных молекул. Клатратные модели рассматривали структуру воды как непрерывный каркас водородных связей, в котором содержатся пустоты, где размещаются молекулы, не связанные с молекулами каркаса. Первую такую модель в 1946 году предложил О.Я. Самойлов. В соответствии с ней структура каркаса воды подобна сетке водородных связей гексагонального льда, а полости в нем частично заполнены мономерными молекулами. Другой вариант клатратной модели в 1959 году предложил Л. Полинг. В его модели предполагается, что основой структуры воды может служить сетка связей, присущая некоторым кристаллогидратам. В течение второй половины 60-х годов и начала 70-х появлялись компромисные варианты кластерных и клатратных моделей, допускающие связи между класьтерами и разрывы в каркасе. Было установлено также, что всегда можно подобрать такие свойства и концентрации двух микрофаз кластерных моделей или свойства каркаса и степень заполнения его пустот клатратных моделей, чтобы объяснить все свойства воды, в том числе и знаменитые ее аномалии. Представлениям о воде как о водородно-связанных кластерах, плавающих в море лишённых связей молекул воды, был положен конец в конце 90-х годов ХХ века, когда появились первые экспериментальные исследования структуры воды. Было установлено, что в воде присутствуют взаимодействующие между собой молекулярные агрегаты различных размеров и форм, обладающие различным временем жизни. В 1999 г. С.В. Зенин обосновал геометрическую модель основного стабильного структурного образования из молекул воды (структурированная вода), а также получил изображение подобного агрегата с помощью контрастно-фазового микроскопа этих структур. Андерс Нильсон подтвердил выводы Зенина, изучив строение воды с использованием мощного рентгеновского микроскопа. Он установил, что в воде молекулы формируют не одну структуру, а одновременно два типа структур, сосуществующих в ней вне зависимости от температуры. Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен. Увеличение температуры вплоть до точки кипения воды приводит к изменению соотношения между числом молекул, входящих в упомянутые сгустки и находящихся в неупорядоченном состоянии. Их доля в сгустках уменьшается. "Этот процесс можно представить как танцевальный клуб, где часть людей сидит за столиками, отражая упорядоченную компоненту воды, а часть находясь в толпе, непрерывно перемещается в танце, отражая разупорядоченную. Увеличение температуры воды в этом случае можно сравнить с всеобщим поднятием настроения и ускорением музыки, когда люди начинают вставать из-за столов и присоединяться к танцующим, а часть пустующих столов и вовсе убирается для высвобождения места. Охлаждение - обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же "температуре" танцующие и сидящие люди постоянно меняются местами - некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним" - пояснил результаты работы Нильсон. Это, в частности, объясняет нелинейную зависимость плотности воды от температуры - упорядоченные скопления молекул имеют меньшую плотность, чем неупорядоченные, и она мало меняется с изменением температуры, которую можно сравнить с постоянным размером столов, не зависящим от настроения собравшихся или громкости музыки в ресторане. Дэнфорд и Леви также провели рентгеноструктурное исследование жидкой воды. Они показали, что в воде может присутствовать льдоподобный каркас и неупорядоченные молекулы воды, как в модели Самойлова. Этот результат не позволяет полностью отвергнуть клатратные модели, допуская их продуктивность в ряде специальных случаев (вблизи поверхностей раздела фаз, макромолекул и т.п.), а также в комбинированных моделях (Марчи-Эиринг). Показано также, что тэтраэдрический порядок в расположении молекул воды по мере повышения ее температуры все более и более нарушается. Вследствие увеличения средней скорости движения ее молекул некоторые связи между ними разрываются. В результате начинается распад самых крупных молекулярных агрегатов на более мелкие. Удивительным свойством водородных связей является их способность удерживать молекулы воды в молекулярных агрегатах не жестко - при различных их взаимных ориентациях. Благодаря этому вероятно молекулярным агрегатам свойственен относительный полиморфизм (геометрические конфигурации агрегатов, имеющих одинаковую молекулярную массу, могут быть различны). Установлено, что вода жидкая содержит также молекулярные агрегаты, различающиеся между собой числом объединившихся молекул (а значит и молекулярной массой). Распределение молекул воды по агрегатам с той или иной молекулярной массой зависит от предыстории изменения ее температуры и других оказываемых на нее внешних воздействий. При одной и той же температуре вода, которая ранее была талой и вода, которая ранее была кипяченой, обладают различными распределениями своих молекул по молекулярным агрегатам. У воды, которая ранее была холоднее, сохраняется больше молекулярных агрегатов высокого порядка (т.е. содержащих большое число молекул). На изменение распределений молекулярных агрегатов жидкой воды по их молекулярным массам и конфигурациям способны оказывать влияние механические воздействия (перемешивание), внешние электрические и другие поля. Воздействующим объектом может быть и человек. Информация о подобных взаимодействиях надолго сохраняется в структуре воды, которая представляет собой множество молекулярных агрегатов различных типов. К образованию очень правильных симметричных и красивых гексогональных структур приводит упоминание над водой , имени богини Аматерасу, а также , слово «спасибо». К иным последствиям приводит угроза. В этом нетрудно убедиться рассмотрев следующие фото:
Структуры, образующаяся в воде над которой произнесены фразы Слева, - «Я тебя убью!». Справа, -«Спасибо!» Структуры , образующиеся в воде под воздействием музыки:
Тяжёлый рок "Пастораль" Бетховена Музыка Моцарта и Бетховена приводит к образованию неизменно веселой россыпи правильных кристаллов, тяжелый же рок –к образованию абсолютно разупорядоченной структуры. Сравнивая структуру воды в клетках младенца и взрослого человека, Я. Катаяма обнаружил, что в организме младенца вся клеточная вода группируется исключительно в гексагональную структуру, в отличие от людей старшего возраста. Причем количество молекул воды, объединяющихся в гексагон, было минимальным из возможного – шесть. Именно при такой структуре с шестью молекулами в одном кластере, вода является биоактивной, максимально эффективно выполняя свои функции в организме. Уже у 30-летнего человека доля микрокластерной воды в клетках падала до 60 процентов. Чем старше человек, тем более разупорядоченной становится структура воды в его клетках и тем больше он нуждается в микро - кластерной воде. Клеточная вода в куске мертвой ткани животного, в испорченных овощах и фруктах идентична воде из- под крана, теряя свою гексогональную структуру. Д. Шик установил что в организме больных раком людей микрокластеры меняют свою форму с гексагональной (шестигранной) на пентагональную (пятигранную). Более того, наиболее популярные в мире обратноосмотические системы очистки воды на выходе дают именно такие пентагонально структурированные микрокластеры воды. То есть, химически чистая вода, образующаяся в них, может представлять опасность для здоровья человека! В природе имеет гексагональную микрокластерную структуру также талая вода, оживляющая по весне животных и растений от зимней спячки , вода с ледников, а также клеточная вода фруктов и овощей (сок), вода из очень немногих источников или скважин. Кровь животных и человека может иметь микрокластерную структуру только в случае потребления ими единственно микрокластерной биоактивированной воды. Возможно, гексагональная сингония водяных кристаллов является необходимым строительным каркасом, обеспечивающим нормальное функционирование клетки. Так, Д. Шик в своей книге «Вода долгой жизни» пишет, что мельчайшая водяная частица, на которой природа основала жизнь, это не единичная молекула воды, а водяное кольцо, состоящее из шести молекул H2O. При отсутствии микрокластерной воды или наличии ее ниже определенного предела клетка, судя по всему, просто перестает функционировать. Многие источники указывают на то, что микрокластерная вода поддерживает и оздоравливает молекулу ДНК, группируясь вокруг нее. Молекула же ДНК является главным маркером при срабатывании механизма самоубийства - апоптоза. В принципе, это относится к любым белковым образованиям в наших клетках. Вокруг здоровых белковых молекул формируется каркас из гексагональных кластеров воды. Вокруг же больных, частично разрушенных – ничего нет. – Вода как бы расступается, уходит, оставляя без защиты дефектные молекулы белка. Таким образом, оптимизация содержания гексагональной микрокластерной воды в клетке может являться важным фактором долголетия. Установлено, что вода является источником сверхслабого и слабого переменного электромагнитного излучения. Наименее хаотичное электромагнитное излучение создаёт структурированная вода. В таком случае может произойти индукция соответствующего электромагнитного поля, изменяющего структурно-информационные характеристики биологических объектов. Свойства воды становятся еще сложнее, если вспомнить о том, что в природе каждый из элементов, образующих молекулу воды, может быть представлен тремя изотопами. Для кислорода это : О16 , О17 и О18. Водород также встречается в виде трех изотопов из которых два Н1 (протий) и Н2(дейтерий, Д) являются стабильными, а один – Н3(тритий, Т) – радиоактивным. Ядро атома Д кроме протона содержит также один нейтрон. Ядро атома трития (Т), кроме протона содержит два нейтрона. Тритий – радионуклид с периодом полураспада 12,4 года, распадающийся с образованием гелия He3 и β-частицы, имеющей энергию 17,6 кэв . Тритий содержится в атмосфере в концентрации 4* 10 –15 и образуется в результате ядерной реакции N14+ n1 = C12 + H3. Здесь:N14- ядро атома азота с массой 14; n1 - нейтрон с массой 1; C12- ядро атома стабильного изотопа углерода с массой 12. Поэтому фактически, встречающаяся в природе «вода» представляет собой смесь девяти стабильных, но различных по своему составу и свойствам жидкостей : Н12О16, Н12О17, Н12О18, Н 1Д2 О16, Н1 Д2О17, Н1Д2О18,Д12О16, Д12О17, Д12О18. Дитрих установил количества, в которых встречаются на нашей планете различные по своему изотопному составу виды воды. Сведения об этих количествах представленны в таблице 1 Таблица 1. Компоненты воды по Дитриху и их содержание на Земле.
Кроме того, в незначительных количествах (всего около 800 г на весь Мировой океан) встречается радиоактивная т. н. «сверхтяжелая вода» Н32 О16. Физико-химические свойства изотопов водорода и их оксидов существенно различаются. В этом нетрудно убедиться из таблицы 2.
Таблица 2. Физико-химические свойства изотопов водорода и их наиболее распространенных оксидов.
Содержание тех или иных видов воды в различных водоемах, а также их частях различно и заранее непредсказуемо. Несмотря на значительные успехи в исследованиях структуры жидкой воды, проблема объяснения всех ее аномальных свойств в наши дни по прежнему далека от своего решения. Ни одна из существующих теорий объясняя те или иные ее физико-химические свойства, не объясняет их все в комплексе. Поэтому вполне удовлетворительными ни одна из них не является, а исследования в данном направлении продолжаются. Влияние растворенных веществ на структуру воды Жидкая вода, встречающаяся в биосфере, является раствором большинства химических соединений, встречающихся в природе. Процесс загрязнения природных вод примесями начинается уже в атмосфере. Капли воды, образующие облака, туманы и жидкие атмосферные осадки, сорбируют из окружающей воздушной среды всевозможные газообразные вещества, в том числе и окислы углерода, серы, а также азота. Так как в жидкой среде молекулы этих веществ прочно связаны с молекулами воды, обратный их выход за пределы капель оказывается практически невозможен. В результате концентрация этих молекул в каплях воды многократно превышает их концентрацию в воздухе. Последнее делает возможным образование в каплях под действием солнечной радиации различных кислот. Даже чистейшая, не содержащая техногенных примесей роса имеет рН=5.5, т.е. является существенно «подкисленной». Выпав на земную поверхность, вода взаимодействует с горными породами и почвенным слоем. Даже если бы вода имела нулевую кислотность (рН=7), выпав на подстилающую поверхность, она постепенно насыщалась бы различными растворимыми химическими соединениями. Присутствующие в воде кислоты существенно интенсифицируют этот процесс, превращая многие нерастворимые соединения в растворимые. Учитывая это свойство воды, академик Опарин предположил, что на некоторой стадии эволюции нашей планеты в ее водоемах смогли сформироваться такие растворы, в которых смогла самозародиться жизнь. Поскольку рассмотрим особенности структуры воды, содержащей растворимые вещества. Ионы растворенных веществ сильно взаимодействуют с электрическими полями молекул воды, -гидратируются. Это взаимодействие приводит к образованию вокруг каждого иона водной оболочки. Вода, образующая эту оболочку является связанной. Ока утрачивает способность перетекать под действием силы тяжести из одной точки проетранства в другую и называется гидратационной. Вследствие того, что сила кулоновского притяжения убывает обратнопропорционально квадрату расстояния между зарядами, упомянутая водная оболочка (атмосфера) эффективно экранирует зяряд иона. Многие электролиты удерживают гидратационную воду, настолько прочно, что даже в том случае, когда их растворы выпаривают, образующаяся твердая фаза кристаллизуется с определенным числом молекул воды. Так ведут себя, к примеру, CuSO 4-5H 2O (медный купорос). Гидратационная оболочка иона в растворе не является простым обособленным комплексом. Она имеет сложную внутреннюю структуру, а ее внешние границы в действительности невозможно установить.Внутри гидратационной оболочки можно отметить несколько состояний молекул воды, которым соответствуют связи разной силы. Связь, образующаяся между ионами некоторых переходных элементов и гидратационными молекулами воды, имеет преимущественно ковалентный характер. В случае наличия в растворе простых одновалентных катионов, таких, как катионы щелочных металлов, указанная связь имеет почти полностью ионный характер и с относительной легкостью может быть рассмотрена теоретически на основе электростатических представлений. Для большинства ионов, играющих главную роль в химии атмосферной воды важнейшим фактором, определяющим размер и прочность гидратной оболочки, является поверхностная плотность заряда иона. Чем выше плотность заряда, тем сильнее экранирован ион. Из этого правила можно сделать следующие выводы: Катионам свойственна более сильная гидратация, чем анионам. Чем выше заряд иона, тем сильнее он гидратируется. При одинаковом заряде, сильнее гидратируются ионы, имеющие меньший радиус. Кулоновские поля ионов взаимодействуют с диполями молекул воды достаточно сильно, чтобы подтянуть их к себе. Вследствие этого внепосредственной близости от ионов происходит сжатие растворителя. Удельный объем воды вблизи иона оказывается больше, чем на некотором удалении от него. Это явление называется электрострикцией. Рассмотрим влияние растворенных веществ на структуру воды, Предположим, что находящийся в растворе ионокружен двумя слоями (рис. 4). Внутренний слой (А), который можно отождествить с тем, что называют сферой «первичной» гидратации, более плотный благодаря электрострикции, а находящиеся в нем молекулы воды менее подвижны и образуют сильные связи с ионом в его кулоновском поле. Во внешнем слое (С) эффект электрострикционного уплотнения не наблюдается (молекулы воды остаются «нормальными», хотя они могут быть очень слабо поляризованы электрическим полем). Особый интерес представляет промежуточный слой (В). В нем кулоновское поле иона еще достаточно сильно, чтобы нарушить «нормальную» структуру жидкой воды, но все же оно недостаточно велико, чтобы вызвать переориентацию молекул воды и «намертво» связать молекулы воды (как, например, в слое А).
Рис.4. Влияние растворенных веществ на структуру воды. Следовательно, слой В представляет собой область относительной разупорядоченности, нарушенного расположения молекул воды, разрушенной структуры. Рассмотренные особенности строения воды, содержащей растворенные вещества, существенно влияют на физико-химические свойства водных растворов. Рассмотрим это влияние на примере наиболее распространенного водного раствора - морской воды, которую упрощенно можно рассматривать как водный раствор соли NaCl. В водной среде ионная связь между атомами Na и С1 разрывается более сильными электрическими полями молекул воды. Образующиеся при этом ионы изменяют структуру воды, подобно тому, как указано выше. В результате изменяются важнейшие физические свойства воды. В частности, при повышении солености воды уменьшаются величины температуры замерзания и температуры максимальной плотности. При солености менее 24.6 промилле температура максимальной плотности морской воды выше, чем температура замерзания (аномальный характер зависимости ее плотности от температуры сохраняется). При солености более 24.6промилле температура замерзания оказывается выше, чем температура максимальной плотности. В итоге зависимость плотности такой соленой воды от температуры становится, как и у других жидкостей -нормальной» (чем теплее вода - тем меньше плотность). Именно благодаря этому Мировой океан покрывается льдом гораздо дольше, чем пресноводные водоемы. В нем зимняя конвекция не прекращается даже в самые сильные морозы и проникает на большие глубины, способствуя их аэрации и захоронению полютантов, осевших из атмосферы на поверхность. В пресноводных водоемах зимняя конвекция прекращается, как только температура глубинных слоев понижается до значения температуры максимальной плотности. Далее тонкий приповерхностный слой быстро охлаждается холодным воздухом (его плотность при этом становится все меньше) до замерзания. Глубинные слои пресноводных водоемов сохраняют положительною температуру даже при самых свирепых морозах (что имеет большое положительное значение для их обитателей). Увеличение солености морской воды при неизменной ее температуре ведет к увеличению ее электропроводности, плотности, вязкости, коэффициента поверхностного натяжения, скорости звука. Следует отметить, что у некоторых других электролитов, например водного раствора KCl, увеличение солености вязкость напротив уменьшает. Испарение с поверхности соленых водоемов происходит иначе, чем с поверхности пресных. Чем выше соленость вод, тем при прочих равных условиях испарение с его поверхности происходит более интенсивно. Присутствие в мельчайших капельках воды солей существенно влияет на процесс конденсации водяного пара на их поверхность. Чем выше соленость, тем на капельках радиусами менее 1 микрона конденсация идет интенсивнее. Cписок литературы: Г.Г. Маленков. Успехи физической химии, 2001 С.В.Зенин, Б.М. Полануер, Б.В. Тяглов. Экспериментальное доказательство наличия фракций воды. Ж. Гомеопатическая медицина и акупунктура. 1997.№2.С.42-46. С.В. Зенин, Б.В. Тяглов. Гидрофобная модель структуры ассоциатов молекул воды. Ж.Физ.химии.1994.Т.68.№4.С.636-641. С.В. Зенин Исследование структуры воды методом протонного магнитного резонанса. Докл.РАН.1993.Т.332.№3.С.328-329. С.В.Зенин, Б.В.Тяглов. Природа гидрофобного взаимодействия. Возникновение ориентационных полей в водных растворах. Ж.Физ.химии.1994.Т.68.№3.С.500-503. С.В. Зенин, Б.В. Тяглов, Г.Б.Сергеев, З.А. Шабарова. Исследование внутримолекулярных взаимодействий в нуклеотидамидах методом ЯМР. Материалы 2-й Всесоюзной конф. По динамич. Стереохимии. Одесса.1975.с.53. С.В. Зенин. Структурированное состояние воды как основа управления поведением и безопасностью живых систем. Диссертация. Доктор биологических наук. Государственный научный Центр «Институт медико-биологических проблем» (ГНЦ «ИМБП»). Защищена 1999. 05. 27. УДК 577.32:57.089.001.66.207 с. В.И. Слесарев. Отчет о выполнении НИР по теме: «Воздействие фрактально-матричных транспарантов «Айрес» на характеристики структурно-информационного свойства воды». Санкт-Петербург. 2002. С.В. Зенин, М.Ф.Меркулов, Д.Г. Мирза. Исследование медико-биологических свойств матричных аппликаторов «Айрес». Результаты апробации матричных аппликаторов «Айрес». СПб,2000.с.14-21. Масару Эмото. Послания воды: Тайные коды кристаллов льда. Перев. с англ. М. ООО Издательский дом «София».2005. Резников К.М. Вода жизни //Прикладные информационные аспекты медицины. – 2001. – Т.4. - №2. С.3-10. О.В. Мосин, Д.А. Складнев, В.И. Швец. Биотехнология, Исследование физиологической адаптации бактерий к тяжёлой воде. 2001 г.
. Посмотрите опять:
Гитлер Мать Тереза Вода говорила! И разгадка этого языка сулила открытия почище Ньютоновского или Эйнштейновского! Впрочем, доктор Лоренцен журавлю в небе предпочел вполне осязаемую синицу. - Им был разработан и запатентован процесс ревитализации воды – изменения ее структуры с беспорядочной на гексагональную или микрокластерную. Он же провел совершенно невероятный по масштабу эксперимент по ее апробации. Результаты были более чем положительные, – вода не просто оздоравливала, – она восстановила ослабленный жизненный потенциал у десятков тысяч людей. Причину такого воздействия объясняло другое открытие того же времени: Сравнивая структуру воды в клетках младенца и взрослого человека ("Aging Mechanism Associated with a Function of Biowater." Physiol Chem Phys & Med NMR 1992 24:43-50.), доктор Катаяма обнаружил, что в организме младенца вся клеточная вода группируется исключительно в гексагональную структуру, в отличие от людей старшего возраста. Причем количество молекул воды, объединяющихся в гексагон, было минимальным из возможного – шесть. Именно при такой структуре с шестью молекулами в одном кластере, вода является биоактивной, максимально эффективно выполняя свои функции в организме. Уже у 30-летнего человека доля микрокластерной воды в клетках падала до 60 процентов. Клеточная же вода в куске мертвой ткани животного, в испорченных овощах и фруктах становится идентичной воде из- под крана, теряя свою микрокластерную структуру. Другими исследованиями (Dr. Mu Shick Jhon и др.) установлено что в организме больных раком людей микрокластеры меняют свою форму с гексагональной (шестигранной) на пентагональную (пятигранную). Более того, согласно Aqua Technology, наиболее популярные в мире обратноосмотические системы очистки воды на выходе дают именно такие пентагонально структурированные микрокластеры воды. То есть, чистая вода может быть больной?! В свете фактов такого рода, имеем ли мы право закрывать глаза на все, что не находится в прямой связи с процессом очистки воды от загрязнений? Ведь любое упоминание о биоактивации воды считается в подавляющем большинстве серьезных «водяных» организаций дурным тоном. Не составляла исключения и та , в которой последнее время работал и я сам (лаборатория "Подземных вод" Массачусетского университета). В дополнение к вышеизложенному химики Р. Мак-Киннон и П. Эгр (Нобелевская премия по химии за 2003 год) установили, что специальный механизм образования пор в клеточной мембране позволяет проникать в клетку лишь одиночным молекулам воды. Ассоциаты воды любого размера в клетку не проникают. Однако именно юнит из шести молекул H2O, обладая наибольшей мобильностью и способностью разложения на элементарные составляющие, является лучшим буксировщиком воды к порам клеточных мембран. И, согласно Катаяме, уже внутри клетки молекулы H2O объединяются в тот же самый универсальный шестиугольный юнит. Некоторые из учёных считают, что водяные ассоциаты большего размера «неадекватно» воспринимаются организмом и, вполне возможно, утилизируются обычным путём через мочевой пузырь! Мы способны пить воду, и при этом ею не напиваться. И, наоборот, очень небольшое количество биоактивированной воды способно утолить сильную жажду. Вот вам еще один замечательный тест на степень биоактивности воды. – Насколько редко вы бегаете в туалет, попив такой водички. Какая вода в природе имеет гексагональную микрокластерную структуру? Это, прежде всего, талая вода, оживляющая по весне животных и растений от зимней спячки и вода с ледников. Клеточная вода фруктов и овощей (сок), вода из очень немногих источников или скважин. Первый человек, француз, в одиночку переплывший Атлантический океан в гребной лодочке, утолял жажду рыбным соком, выжимая рыбину, как мокрое белье, перекручивая. Кровь животных и человека может иметь микрокластерную структуру только в случае потребления ими единственно микрокластерной биоактивированной воды! В обычных же случаях насытить жажду кровью представляется затруднительным. Другое дело – клеточная вода. Однако если из рыбы для сильного человека добыть ее не представляет труда, то, как это сделать из животного, я лично не имею понятия, да и думать об этом, честно говоря, не хочется. Слава Богу, есть гораздо более приемлемые способы качественно утолить свою жажду. Однако, в случае необходимости, имейте все вышесказанное в виду. Чем старше человек, тем более разупорядоченной становится структура воды в его клетках и тем больше он нуждается в микро - кластерной воде. Возможно, гексагональная сингония водяных кристаллов является необходимым строительным каркасом, обеспечивающим нормальное функционирование клетки. Так, доктор Джон Му Шик (Dr. Mu Shick Jhon) в своей книге «Вода долгой жизни» пишет, что мельчайшая водяная частица, на которой природа основала жизнь, это не единичная молекула воды, а водяное кольцо, состоящее из шести молекул H2O. При отсутствии микрокластерной воды или наличии ее ниже определенного предела клетка, судя по всему, просто перестает функционировать. Многие источники указывают на то, что микрокластерная вода поддерживает и оздоравливает молекулу ДНК, группируясь вокруг нее. Молекула же ДНК является главным маркером при срабатывании механизма самоубийства - апоптоза, рассмотренного в главе, посвящённой долголетию из книги "Не Оставляя Ни Следа или Записки Практикующего". В принципе, это относится к любым белковым образованиям в наших клетках. Вокруг здоровых белковых молекул формируется каркас из гексагональных кластеров воды. Вокруг же больных, частично разрушенных – ничего нет. – Вода как бы расступается, уходит, оставляя без защиты дефектные молекулы белка. Таким образом, оптимизация содержания гексагональной микрокластерной воды в клетке может являться важным фактором долголетия. Так или иначе, у исследователей есть теперь главный критерий, определяющий степень биоактивности воды. Это – наличие или отсутствие гексагональных микрокластеров в ее структуре. Вот ещё несколько фотографий, взятых из книги Масаро Емото:
"Фонтан Лурдез"(Франция) Река Йодо (Япония) С.Практикующий. "Вода УДИВИТЕЛЬНАЯ или как превратить воду в ВОДУ " ВОДА Как появилась вода и сколько ее на нашей планете "Тобою наслаждаются, не ведая, что ты такое", - обращался к воде Антуан де Сент-Экзюпери. Тот самый, что написал прекрасную сказку о маленьком принце. И там вода играла не последнюю роль: принц постоянно помнил, что надо поливать свою единственную розу, оставленную на далекой родной планете. Мы не можем прожить без воды и нескольких дней. Между тем долгие столетия люди не только не знали, что она собой представляет, но не знали даже, сколько ее на Земле. И уже совсем было неясно, как появилась она на планете. Вода была еще до появления человека: есть все основания полагать, что жизнь возникла в водной среде. А до возникновения жизни? Вода - активный созидатель нашей планеты, один из ее основных "строительных материалов". Миллиарды лет назад в холодном газопылевом облаке, со временем сгустившемся, уплотнившемся и ставшем Землей, уже содержалась вода. Скорее всего, она была в виде ледяной пыли. Это подтверждают исследования Вселенной. Установлено, что исходные элементы для образования воды - водород и кислород - в нашей Галактике принадлежат к шести самым распространенным веществам космоса. Скопления молекул воды и гидроксидных радикалов обнаружены за пределами Солнечной системы. В созвездиях Кассиопеи и Ориона найдены облака, состоящие из молекул воды. Размеры облаков колоссальны - их протяженность в 40 раз превышает расстояние от Солнца до Земли. Нередки случаи падения на Землю остатков кометных ядер - "посланцев" далеких миров. Чаще всего они представляют собой гигантские глыбы льда, смерзшегося с метаном, аммиаком и минеральными частицами. Вес достигших Земли ледяных глыб может достигать сотен килограммов. Многолетними исследованиями геологических процессов, происходящих на нашей планете, академик АН Украины Н.П. Семененко установил, что именно вода и составляющие ее элементы играли определяющую роль во всей геологической истории Земли. Исследуя содержание кислорода в составе земной коры, ученый сделал вывод, что в образовании протоземли участвовали громадные количества воды. Помимо этого, ее элементы входили в состав основных компонентов исходного облака: водород - в состав гидридов металлов, кислород - в состав оксидов. Согласно теории академика А.П. Виноградова, протоземное облако постепенно уплотнялось и саморазогревалось. Источником необходимой энергии служили процессы радиоактивного распада и уплотнения первичного вещества планеты. С незапамятных времен в недрах планеты происходят глубинные физико-химические процессы. Там развиваются чудовищные давления и температуры; исходные вещества при этом испытывают сложные превращения. В результате образуются паро- и газообразные соединения, причем большинство из них состоит из воды или составляющих ее элементов. Согласно геохимической модели нашей планеты, созданной Н.П. Семененко, земная кора, состоящая из окисленных пород, является своеобразным кислородным каркасом, а ядро планеты слагают гидриды нескольких металлов и частично карбид железа. В зонах самых высоких давлений и температур выделяются, преимущественно, водород и углеводороды. Дальше от центра планеты эти вещества взаимодействуют с окисленными породами - образуются водяной пар и углекислый газ. Эти соединения постоянно выделяются на поверхность через жерла вулканов, через всевозможные наземные и подводные трещины и разломы земной коры. По подсчетам Н.П. Семененко, за всю историю существования Земли на ее поверхность таким образом выделилось около 3,4·109 км3 воды. Треть этого количества в парообразном состоянии покинула поверхность планеты, а под воздействием Солнца значительная часть фотодиссоциировала на водород и кислород. Остальная масса воды, очевидно, постепенно составила гидросферу. Появившись на поверхности планеты таким сложным путем, вода не стала инертной, пассивной средой. Вместе с парами воды выделялись не только оксиды углерода, но и соединения азота, фосфора, серы, которые вместе с кислородом, углеродом и водородом составляют химическую основу жизни. Наиболее благоприятные условия для появления и развития жизни создались в водной среде. "Именно вода гидросферы явилась той обязательной, незаменимой средой, в которой происходило формирование наиболее сложных органических соединений, послуживших в дальнейшем материалом для построения тел живых существ. Вода и сейчас является наипростейшим, но количественно преобладающим химическим компонентом "живой материи" - всей совокупности организмов, населяющих нашу планету!", - так оценивает роль воды в возникновении биосферы биохимик А.И. Опарин. В настоящее время подсчет количества воды на Земле выполнен со всей точностью, доступной современной науке. Эту работу ученые проделали в рамках программы Международного гидрологического десятилетия 1964-1974 гг. Результаты этой работы опубликованы в многотомном труде "Мировые водные ресурсы и водный баланс земного шара". Установлено, что гидросфера - океаны, моря, реки, озера, болота, атмосферная влага - измеряется внушительной величиной - 1,385*10 9 км 3 воды, или 1,4*10 19 т. Три четверти поверхности планеты покрыто водой. Космонавты неоднократно отмечали, что из космоса Земля выглядит голубой планетой с относительно небольшими вкраплениями суши. Голубая планета? Пожалуй, не планета, а только ее тонкая оболочка. Если распределить всю воду равномерно по поверхности земного шара, средний радиус которого 6370 км, получится пленка толщиной менее 3 км. Не много воды в общем объеме планеты. К тому же, основную часть нашего водного потенциала составляет вода, которой не напьешься, не используешь ни в промышленности, ни в сельском хозяйстве, ни в быту. 97,75% или 1,338*10 9 км 3, - это соленые воды океанов и морей. Остальные 2,25% - пресные воды, однако, половина их - 24*10 6 км 3 - "законсервирована" в виде ледяных гигантских шапок Антарктиды, Арктики, Гренландии, высоких гор в различных районах Земли. Примерно столько же воды - 23,4*10 6 км 3 - скрыто от людских глаз в толще земной коры. Это подземные воды. Объем доступной пресной воды исчисляется уже не миллионами, а тысячами кубических километров. Больше всего пресной воды на земной поверхности накоплено в озерах -176,4*10 3 км 3. Если на мгновение задержать течение всех рек земного шара, то оказалось бы, что в их руслах одновременно находится 2120 км3 воды. Истоки множества рек, больших и малых, находятся в болотах, которые содержат 10300 км3 пресной воды. 13000 т воды содержится в ближайших к земной поверхности слоях атмосферы. На высоте до 1 км концентрация водяного пара в воздухе в среднем составляет 2%. Вот, пожалуй, и вся вода, на которую может реально рассчитывать человечество теперь и в ближайшем будущем. Так ли проста вода "Простейшее устойчивое соединение водорода с кислородом", - такое определение воды дает Краткая химическая энциклопедия. Все верно, только простейшее в химии - это далеко не простое. До XIX века люди не знали, что вода - химическое соединение. Ее считали обычным химическим элементом. Лишь в 1805 году Александр Гумбольдт и Жозеф Луи Гей-Люссак установили, что вода состоит из молекул, каждая из которых содержит два атома водорода и один кислорода. После этого свыше ста лет все и всюду считали, что вода _ индивидуальное соединение, описываемое единственно возможной формулой H2O. Недостаточность этого положения выяснилась лишь в 1932 году. Мир облетела сенсация: кроме воды обычной, в природе существует еще и тяжелая вода. В молекулах такой воды место водорода занимает его тяжелый изотоп - дейтерий. Тяжелую воду открыли американские физики Гаральд Юри и Эльберт Осборн. В 1933 году американец Герберт Льюис совместно с Ричардом Макдональдом впервые выделили ее в чистом виде. В небольших количествах тяжелая вода постоянно и повсеместно присутствует в природных водах, внешне совершенно не отличаясь от обычной воды. Различить их можно лишь по физическим характеристикам. В молекулу тяжелой воды входят атомы не легкого водорода - протия (1H), а его изотопа - дейтерия (2D), атом которого на единицу тяжелее протиевого, следовательно, молекулярный вес тяжелой воды на 2 единицы больше: 20, а не 18. Формула тяжелой воды D2O. Она на 10% плотнее обычной, ее вязкость выше на 23%. Она кипит при 101,42 oС, а замерзает при +3,8 oС. Такие особенности позволяют понять не равномерность содержания тяжелой воды в тех или иных природных водах. Например, в замкнутых водоемах ее больше, так как по сравнению с обычной водой она испаряется менее интенсивно. Поэтому тяжелой воды больше в местностях с жарким климатом. Обогащается дейтерием и поверхность океана на экваторе и в тропиках, тем более что свою лепту вносят частые атмосферные осадки, при образовании которых идут процессы конденсации воды из паровой фазы (см. далее), а тяжелая вода конденсируется быстрее, чем легкая, следовательно, осадки обогащены тяжелой водой. Однако для океанской поверхности повышенное содержание тяжелой воды характерно лишь на низких широтах. Вблизи полюсов свои особенности. В высоких южных широтах (в Антарктике) океанские воды заметно "легче". В этом сказывается влияние талых вод антарктических айсбергов, которые отличаются наиболее низким содержанием дейтерия на планете. Невелика доля дейтерия и во льдах Гренландии, тем не менее, океанские воды высоких северных широт обогащены тяжелой водой. Тут сказывается таяние "тяжелых" арктических льдов. Собственно тяжелая вода D2O в природе находится в ничтожных количествах - в миллионных долях процента. Преобладает ее разновидность, состав которой можно выразить формулой HDO. Тяжелая вода - очень важное промышленное сырье, эффективный замедлитель быстрых нейтронов. Поэтому уже сейчас ее широко применяют в различных реакторных установках. А в будущем тяжелая вода может стать сырьем для термоядерной энергетики: 1 г дейтерия при термоядерном распаде дает в 10 млн. раз больше энергии, чем 1 г угля при сгорании. В Мировом океане содержится 1015 тонн HDO. Открытия последних лет показали, что тяжелая вода играет немалую роль в биологических процессах. Это и понятно, ведь она является постоянной и повсеместной примесью природных вод. Систематическое изучение ее воздействия на животных и растения начато сравнительно недавно. Различные исследователи независимо друг от друга установили, что тяжелая вода действует отрицательно на жизненные функции организмов; это происходит даже при использовании обычной природной воды с повышенным содержанием тяжелой воды. Подопытных животных поили водой, 1/3 часть которой была заменена водой состава HDO. Через недолгое время начиналось расстройство обмена веществ животных, разрушались почки. При увеличении доли тяжелой воды животные погибали. На развитие высших растений тяжелая вода также действует угнетающе; если их поливать водой, на половину состоящей из тяжелой воды, рост прекращается. Пониженное содержание дейтерия в воде стимулирует жизненные процессы. Такие данные получили Б.И. Родимов и И.П. Торопов. Они долгое время наблюдали за растениями и животными, потреблявшими воду, в которой содержалось дейтерия на 25% ниже нормы. Оказалось, что, потребляя такую воду, свиньи, крысы и мыши дали потомство, гораздо многочисленнее и крупнее обычного, яйценоскость кур поднялась вдвое, пшеница созрела раньше и дала более высокий урожай. Первые результаты изучения тяжелой воды показывают, сколько необычных свойств таит такое обыкновенное вещество, как вода. Открытие тяжелой воды послужило толчком к выяснению фракционного состава воды. Вскоре была обнаружена сверхтяжелая вода Т20. В ее составе место водорода занимает его природный изотоп, еще более тяжелый, чем дейтерий. Это тритий (Т), он радиоактивен, атомная масса его равна 3. Тритий зарождается в высоких слоях атмосферы, где идут природные ядерные реакции. Он является одним из продуктов бомбардировки атомов азота нейтронами космического излучения. Ежеминутно на каждый квадратный сантиметр земной поверхности падают 8...9 атомов трития. В небольших количествах сверхтяжелая (тритиевая) вода попадает на Землю в составе осадков. Во всей гидросфере одновременно насчитывается лишь около 20 кг Т20. Тритиевая вода распределена неравномерно: в материковых водоемах ее больше, чем в океанах; в полярных океанских водах ее больше, чем в экваториальных. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при 104 oС, замерзает при 4...9 oС, имеет плотность 1,33 г/см3. Сверхтяжелую воду применяют в термоядерных реакциях. Она удобнее дейтериевой, так как чувствительнее в определении. Перечень изотопов водорода не кончается тритием. Искусственно получены и более тяжелые изотопы 4H и 5H, тоже радиоактивные. Таким образом, возможно существование молекул воды, в которых содержатся любые из пяти водородных изотопов в любом сочетании. Этим не исчерпывается сложность изотопного состава воды. Существуют также изотопы кислорода. В периодической системе химических элементов Д.И. Менделеева значится всем известный кислород 16O. Существуют еще два природных изотопа кислорода - 17O и 18O. В природных водах в среднем на каждые 10 тысяч атомов изотопа 16O приходится 4 атома изотопа 17O и 20 атомов изотопа 18O. По физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная. Получают ее в основном перегонкой природной воды и используют как источник препаратов с меченым кислородом. Помимо природных, существуют и шесть искусственно созданных изотопов кислорода. Как и искусственные изотопы водорода, они недолговечны и радиоактивны. Из них: 13O, 14O и 15O - легкие, 19O и 20O - тяжелые, а сверхтяжелый изотоп - 24O получен в 1970 году. Существование пяти водородных и девяти кислородных изотопов говорит о том, что изотопных разновидностей воды может быть 135. Наиболее распространены в природе 9 устойчивых разновидностей воды (сайт Water.ru: в подлиннике в данной таблице были допущены опечатки, которые мы позволили себе исправить): 1H216O 1H2D16O 2D216O 1H217O 1H2D17O 2D217O 1H218O 1H2D18O 2D218O Оновную массу природной воды - свыше 99% - составляет протиевая вода - 1H216O. Тяжелокислородных вод намного меньше: 1H218O - десятые доли процента. 1H217O - сотые доли от общего количества природных вод. Только миллионные доли процента составляет тяжелая вода D2O, зато в форме 1HDO тяжелой воды в природных водах содержится уже заметное количество. Еще реже, чем D2O, встречаются и девять радиоактивных естественных видов воды, содержащих тритий: 3T216O 1H3T16O 2D3T16O 3T217O 1H3T17O 2D3T17O 3T218O 1H3T18O 2D3T18O
Со всей научной строгостью классической водой следует считать протиевую воду 1H216O в чистом виде, то есть без малейших примесей остальных 134 изотопных разновидностей. И хотя содержание протиевой воды в природе значительно превосходит содержание всех остальных вместе взятых видов, чистой 1H216O в естественных условиях не существует. Во всем мире такую воду можно отыскать лишь в немногих специальных лабораториях. Ее получают очень сложным путем и хранят с величайшими предосторожностями. Для получения чистой 1H216O ведут очень тонкую, многостадийную очистку природных вод или синтезируют воду из исходных элементов 1H2 и 16O2, которые предварительно тщательно очищают от изотопных примесей. Такую воду применяют в экспериментах и процессах, требующих исключительной чистоты химических реактивов. Формально протиевую воду можно было бы назвать легкой водой, но чистая 1H216O - редкость. Поэтому рабочим эталоном легкой воды считают смесь разновидностей воды состава 1H216O, 1H217O и 1H218O, взятых в том же соотношении, в котором присутствуют в воздухе соответствующие изотопы кислорода. Получается, что, широко оперируя понятием "легкая вода", мы не можем представить ее однородной формулой. Термин "тяжелая вода" на практике также не имеет эквивалента. Вода, отвечающая формуле D218O, которую как раз и следовало бы считать тяжелой настоящей водой, фактически заменяется смесью разновидностей воды с постоянной водородной частью (здесь это дейтерий) и с содержанием изотопов кислорода в соответствии с изотопным составом воздуха. Вот какое непростое это "простейшее соединение" - вода. В дальнейшем, говоря о воде и называя ее общепринятую формулу Н2 O, будем иметь в виду, что состав воды, даже полностью освобожденной от минеральных и органических примесей, сложен и многообразен. Глава из книги "Вода знакомая и загадочная"
Леонид Адольфович Кульский, Воля Васильевна Даль, Людмила Григорьевна Ленчина
© Издательство "Радянська школа", 1982; Электронная версия, "НиТ. Раритетные издания", 1998. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 187. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |