
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет теоретического и действительного объёма воздуха, для осуществления реакции горенияСтр 1 из 2Следующая ⇒ Курсовая работа по дисциплине «Основы теории горения».
Выполнил: Проверил: ст. пр. Медведская Е.В.
Новокузнецк 2016 Содержание Введение....................................................................................................................3 1.Исходные данные.................................................................................................4 2. Определение низшей теплоты сгорания для доменного и коксового газа............................................................................................................................4 3.Определение объёмной доли газообразной смеси через низшую теплоту сгорания ...................................................................................................................5 4.Определение процентного состава смешанного газообразного топлива.....................................................................................................................5 5. Табличный метод расчета…………………………….……………………….6 6. Расчет теоретического и действительного объёма воздуха, для осуществления реакции горения.......................................................................................................7 7.Определение теоретического и действительного объёма продуктов сгорания...................................................................................................................8 8. Определение плотности газообразного топлива и продуктов полного сгорания………………………………………………………………………………10 9. Составление материального баланса горения газообразного топлива…………………………………………………………………………………10 10. Невязка баланса…………………………………………………………………..11 11.Определение температуры горения…………………………………………….11 Заключение……………………………………………………………………………14 Список использованной литературы.....................................................................15
Введение  Расчет горения топлива является основой теплотехнического расчета любого нагревательного устройств, использующее топливо. Целью расчета горения топлива является определение: · Теплоты сгорания топлива ( · Теоретического (Lв0) и действительного ( · Теоретического (V0) и действительного (Vд) количества продуктов сгорания; · Состав и плотности продуктов сгорания; · Температуры горения. Эти данные необходимы для расчета теплообмена в рабочем пространстве печи, расчета теплового баланса и всех ее аэродинамических расчетов. Например, объем продуктов сгорания необходимо знать, чтобы рассчитать потери тепла с уходящими газами в тепловом балансе, а также для расчета боровов, дымовой трубы и теплоутилизирующих устройств (рекуператоров и регенераторов). По величине необходимого для горения воздуха рассчитываются воздухопроводы, дутьевые устройства (вентиляторы). Зная состав продуктов сгорания, можно определить парциальные давления составляющих дыма и, таким образом, рассчитывать теплообмен излучением.
Расчет горения газообразного топлива Исходные данные Таблица 1- Процентный состав газообразного топлива наМакеевском заводе
Определениенизшей теплоты сгорания для доменного и коксового газа Так как известно, что смесь доменного и коксового газа имеет низшую теплоту сгорания равную
где n – количество горючих компонентов;
ri– объёмные доли горючих химических веществ топлива. Значения qiпредставлены в таблице 2. Таблица 2 – Тепловые эффекты реакций горения и приближенные молекулярные массы некоторых газов.
Для определения низшей теплоты сгорания доменного и коксового газа воспользуемся формулой (1) ,
Определение объёмной доли газообразной смеси через низшую теплоту сгорания Примем объёмную долю доменного газа равную x, тогда получим:
Выразим из уравнения (2) x: x= 1-x=0,25 Определение процентного состава смешанного газообразноготоплива
Для расчета процентного состава используем формулу (3).
ТАБЛИЧНЫЙ МЕТОД РАСЧЁТА Таблица 3 – Расчет горения газообразного топлива (на 100 м3) (смесь коксового и доменного газа)
АНАЛИТИЧЕСКИЙ МЕТОД РАСЧЁТА Расчет теоретического и действительного объёма воздуха, для осуществления реакции горения Для определения объема кислорода, необходимого для полного окисления горючих компонентов газообразного топлива, необходимо записать уравнения термохимических реакций окисления составляющих топлива для 1 кмоля горючего: СО+0,5O2=CO2; Н2+0,5 О2= Н2О; СН4+2О2 = СО2+2Н2О; С2Н6+3,5О2= 2СО2+3Н2О. Объём газообразного топлива равен 100 м3, получим:
Поскольку объём всех газов, находящихся при нормальных условиях, по следованию закона Авагадро есть величина постоянная Т.к. в качестве окислителя использовался воздух, который содержит 21% O2 и 79% N2 (по объёму), то для определения объёма N2, нужно объём кислорода домножить на соответствующее отношение
Для определения теоретического количества воздуха необходимого для горения 1 м3 топлива,используем следующую формулу:
Расход сухого воздуха, обеспечивающее полное сжигание газообразного топлива в теоретических условиях, т.е. при n = 1,0:
Расход сухого воздуха, обеспечивающее полное сжигание газообразного топлива в действительных условиях, т.е. при n = 1,1:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 352. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 );
); ) количества воздуха;
) количества воздуха; =5 МДж/м3
=5 МДж/м3
 -тепловые эффекты реакций полного горения горючих компонентов топлива, кДж/м3;
-тепловые эффекты реакций полного горения горючих компонентов топлива, кДж/м3;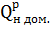 =0,222
=0,222  12636=2805,192кДж/м3;
12636=2805,192кДж/м3; =0,068
=0,068  =
=  ∙x+
∙x+  (1-x)
(1-x)
 =
=  =0,75, тогда
=0,75, тогда
 17,7∙0,75+2,1∙0,25=13,8%;
17,7∙0,75+2,1∙0,25=13,8%; 22,2∙0,75+6,8∙0,25=18,35%;
22,2∙0,75+6,8∙0,25=18,35%; 6,8∙0,75+59,4∙0,25=19,95%;
6,8∙0,75+59,4∙0,25=19,95%; 53,3∙0,75+2,6∙0,25=40,655%;
53,3∙0,75+2,6∙0,25=40,655%; 26,6∙0,25=6,65%;
26,6∙0,25=6,65%; 0,4∙0,25=0,1%;
0,4∙0,25=0,1%; 2,1∙0,25=0,525 %.
2,1∙0,25=0,525 %. =13,8+18,35+19,95+40,9655+6,65+0,1+0,525=100%.
=13,8+18,35+19,95+40,9655+6,65+0,1+0,525=100%. 21,2875
21,2875
 79,33
79,33
 100,6175
100,6175
 39,85
39,85
 34,825
34,825
 120,3575
120,3575
 -
-
 195,03
195,03
 23,426
23,426
 88,126
88,126
 111,532
111,532
 39,85
39,85
 34,825
34,825
 128,33
128,33
 2,1385
2,1385
 205,1435
205,1435
 =0,5∙18,35=9,175м3;
=0,5∙18,35=9,175м3;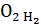 =0,5∙19,95=9,975м3;
=0,5∙19,95=9,975м3;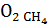 =2∙6,65=13,3м3;
=2∙6,65=13,3м3; =3,5∙0,525=1,8375м3.
=3,5∙0,525=1,8375м3. =22,4 м3/кмоль,то такое же соотношение сохраняется и для м3.
=22,4 м3/кмоль,то такое же соотношение сохраняется и для м3. .
. =9,175∙
=9,175∙  =9,975∙
=9,975∙  =13,3∙
=13,3∙  =1,8375∙
=1,8375∙  = 0,01[0,5СО + 0,5Н2 + 2СН4 + 3,5С2Н6- O2] м3 O2/ м3топлива
= 0,01[0,5СО + 0,5Н2 + 2СН4 + 3,5С2Н6- O2] м3 O2/ м3топлива
 .=
.=  = (1+
= (1+  = 0,01[n∙(0,5СО + 0,5Н2 + 2СН4 + 3,5С2Н6)- O2] м3 O2/ м3 газа
= 0,01[n∙(0,5СО + 0,5Н2 + 2СН4 + 3,5С2Н6)- O2] м3 O2/ м3 газа  =
=  = (1+
= (1+