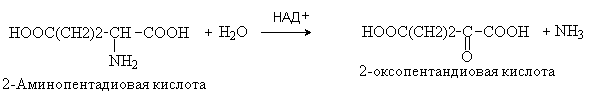Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
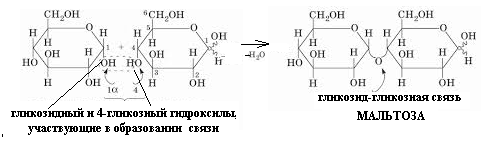
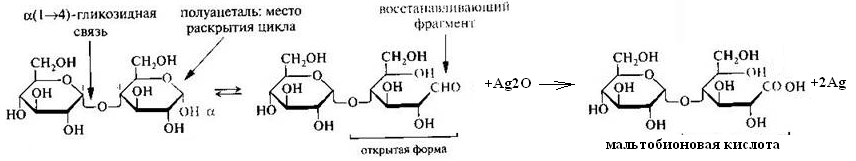
Схема взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса).Дисахариды. Полисахариды 50. Напишите уравнение реакции образования мальтозы. Приведите её полное название. Назовите тип гликозидной связи. Объясните причину восстанавливающей способности мальтозы. Подтвердите Ваш тезис уравнением реакции с аммиачным раствором Ag2O. Укажите эффект реакции. Ответ 1. Уравнение реакции образования мальтозы. 2.Полное название мальтозы:4-О-α-D-глюкопиранозил-D-глюкоза 3.Тип гликозидной связи – α-1,4 гликозидная связь 4.Причина восстанавливающей способности мальтозы: Для образования гликозидной связи использован только один из гликозидных гидроксилов и, следовательно, содержит в скрытой форме альдегидную группу. Альдегидные свойства мальтозы проявляются, в частности, при взаимодействии ее с оксидом серебра в аммиачной среде при нагревании:
Эффект реакции – «серебряное зеркало» (осаждение металлического серебра на стенках пробирки)
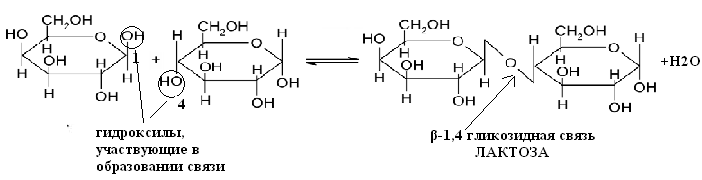
51. Напишите уравнение реакции образования лактозы. Приведите её полное название. Назовите тип гликозидной связи. Объясните причину восстанавливающей способности лактозы. Подтвердите Ваш тезис уравнением реакции с гидроксидом меди (II). Укажите эффект реакции. Ответ 1.Уравнение реакции образования лактозы.
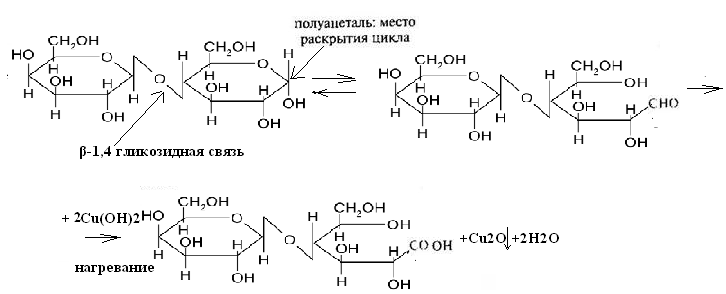
1.Полное название лактозы:4-О-β-D-галактопиранозил-D-глюкоза 3.Тип гликозидной связи - β-1,4 гликозидная связь 4.Причина восстанавливающей способности лактозы:Для образования гликозидной связи использован только один из гликозидных гидроксилов и, следовательно, содержит в скрытой форме альдегидную группу. Альдегидные свойства лактозы проявляются, в частности, привзаимодействии ее с гидроксидом меди (II) при нагревании: 
Эффект реакции – выпадение красного осадка закиси меди Сu2O
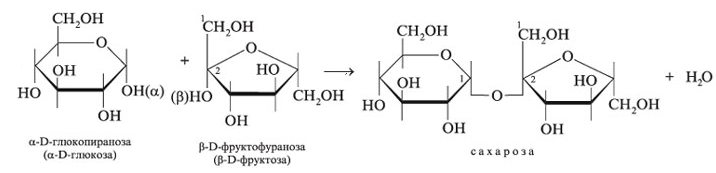
52. Напишите уравнение реакции образования сахарозы. Приведите её полное название. Укажите тип гликозидной связи. Объясните причину отсутствия у сахарозы восстанавливающей способности. Ответ 1.Уравнение реакции образования сахарозы.
2.Полное название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид 2.Тип гликозидной связи:α-1,2 -гликозидная связь 3.Причина отсутствия у сахарозы восстанавливающей способности – в образовании гликозидной связи участвуют обе гликозидные гидроксильные группы. Таким образом, отсутствует возможность их раскрытия и превращения в альдегидные 53. Напишите формулы фрагментов молекул амилозы и амилопектина. Назовите моносахаридные и дисахаридные звенья. Укажите типы гликозидной связи. Объясните отсутствие восстановительной способности у крахмала. Перечислите отличия гликогена от амилопектина, способствующие выполнению его биологической роли. Ответ 1.Формулы фрагментов молекул амилозы и амилопектина
2.Моносахаридные звенья и у амилозы, и у амилопектина – α -D-глюкопираноза. Дисахаридным фрагментом амилозы является мальтоза.При гидролизе амилопектина наряду с мальтозой образуется небольшое количество изомальтозы . 3..Типы гликозидной связи: у амилозы – α- 1,4-гликозидная связь, у амилопектина -α- 1,4 и α- 1,6 -гликозидные связи. 4.Отсутствие восстановительной способности у крахмала объясняется тем, что в образовании гликозидной связи участвуют все гликозидные гидроксильные группы. Таким образом, отсутствует возможность их раскрытия и превращения в альдегидные. 5.Отличия гликогена от амилопектина, способствующие выполнению его биологической роли: А) По строению гликоген подобен амилопектину, но имеет еще большее разветвление цепей. Условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции, так как только при множестве концевых остатков можно обеспечить быстрое отщепление нужного количества молекул глюкозы. Б)Молекулярная масса гликогена больше, чем у амилопектина и достигает 100 млн. Такой размер макромолекул содействует выполнению функции резервного углевода. 54. Напишите формулы дисахаридных фрагментов молекул хондроитинсульфата и гиалуроновой кислоты. Назовите типы гликозидной связи внутри дисахаридных фрагментов и между ними. Укажите биологическую роль перечисленных гетерополисахаридов.
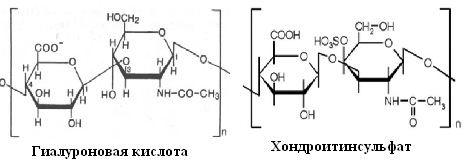
Ответ 1.Формулы дисахаридных фрагментов молекул хондроитинсульфата и гиалуроновой кислоты.
2.Типы гликозидной связи внутри дисахаридных фрагментов – β-1,3 гликозидная связь, между фрагментами - β-1,4 гликозидная связь. 3.Биологическая роль: А)Гиалуроновая кислота является главным компонентом синовиальной жидкости, отвечающим за её вязкость.Гиалуроновая кислота — важный компонент суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита).Гиалуроновая кислота входит в состав кожи, где участвует в регенерации ткани.Гиалуроновая кислота играет важную роль в гидродинамике тканей, участвует в процессе развития опухолей. Б) Хондроитинсульфат стимулирует синтез гиалуроновой кислоты, укрепляя соединительнотканные структуры: хряща, сухожилий, связок, кожи. Оказывает анальгетическое и противовоспалительное действие, является хондропротектором, способствует активной регенерации хряща. Особенностью хондроитина является его способность сохранять воду в толще хряща в виде водных полостей, создающих хорошую амортизацию и поглощающих удары, что в итоге повышает прочность соединительной ткани. Важным действием хондроитина является его способность угнетать действие специфических ферментов, разрушающих соединительную ткань. Аминокислоты. Пептиды
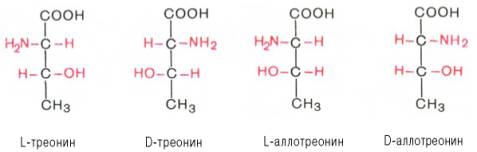
55. Напишите проекционные формулы Фишера для всех изомеров треонина. Объясните, почему эта аминокислота существует в виде четырех пространственных изомеров. Укажите стереоизомер треонина, входящий в состав белков. Назовите другие аминокислоты, содержащиеся в белках, имеющие два хиральных центра.
Ответ 1.Проекционные формулы Фишера для всех изомеров треонина
2.Треонин существует в виде четырех пространственных изомеров, так как у него имеется два хиральных центра: атом углерода, связанный с аминогруппой и атом углерода, связанный с гидроксильной группой. 3.В состав белков входит L-треонин. 4.Содержащиеся в белках аминокислоты, имеющие два хиральных центра: изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин
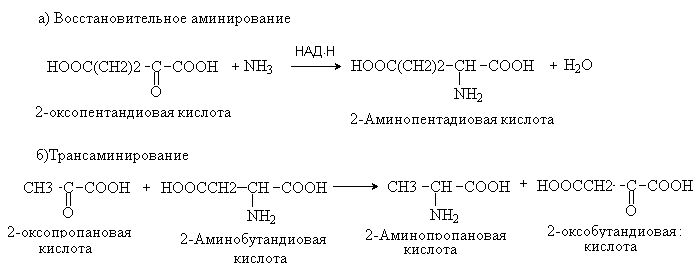
56. Напишите уравнения реакций восстановительного аминирования с участием a-кетоглутаровой кислоты и трансаминирования с участием аспарагиновой и пировиноградной кислот. Назовите все органические соединения, участвующие в реакции, по ЗН ИЮПАК. Ответ Восстановительноеаминирование – метод синтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качестве восстанавливающего реагента. Трансаминирование – основной путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой. Реакция осуществляется при участии ферментов трансаминаз и кофермента пиридоксальфосфата.
57. Напишите уравнения реакций окислительного дезаминированияглутаминовой кислоты (invivo) и неокислительного дезаминирования лейцина (invivo, invitro). Назовите все участвующие в реакции вещества по ЗН ИЮПАК. Укажите биологическое значение реакции дезаминирования. Ответ 1.Уравнение реакцииокислительногодезаминированияглутаминовой кислоты (invivo) . Окислительное дезаминирование происходит при участии ферментов оксидаз и кофермента НАД+, который выступает в качестве окислителя. В результате выделяется аммиак и образуется соответствующая кетокислота.
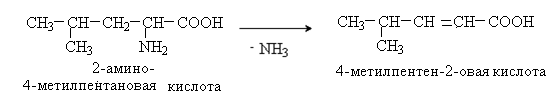
2. Уравнение реакции неокислительного дезаминирования лейцина (invivo). Неокислительное дезаминирование происходит путем отщепления аммиака под действием ферментов с образованием a ,b -непредельных кислот.
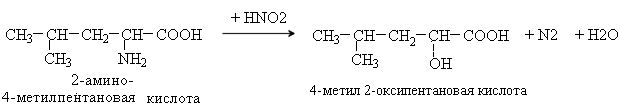
3. Уравнение реакции неокислительного дезаминирования лейцина (invitro). Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
4. Биологическое значение реакции дезаминирования:с помощью реакций дезаминирования снижается избыток аминокислот в организме.
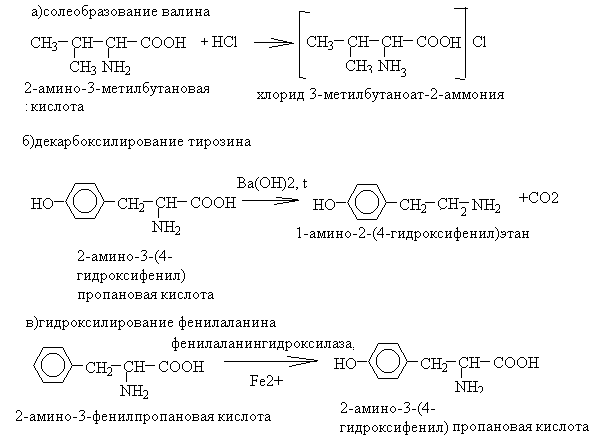
58. Напишите уравнения реакций солеобразования валина, декарбоксилирования тирозина, гидроксилированияфенилаланина. Назовите все участвующие в реакции вещества по ЗН ИЮПАК. Укажите значение этих реакции. Ответ 1.Уравнения реакций
2. Значение реакций: реакции солеобразования используют для защиты аминогруппы при пептидном синтезе, декарбокислирование – один из способов получения биогенных аминов, гидроксилирование фенилаланина – первый этап его метаболизма.
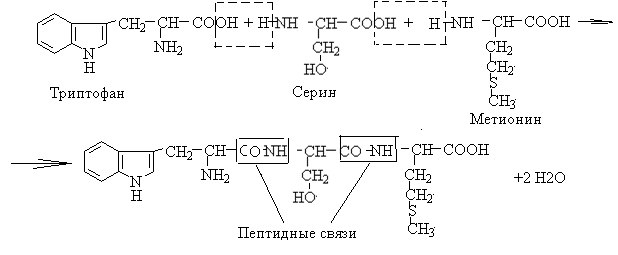
59. Напишите уравнение реакции образования трипептида Три – Сер – Мет. Выделите пептидные связи. Назовите незаменимые аминокислоты, входящие в состав трипептида. Укажите, в какой среде находится ИЭТ трипептида. Объясните роль серина в формировании пространственной структуры пептидов и белков. Ответ 1. Уравнение реакции образования трипептидаТри – Сер – Мет
2.В состав трипептида входят незаменимые аминокислоты триптофан и метионин 3.Изоэлектрическая точка пептида находится в среде, близкой к нейтральной, поскольку входящие в него аминокислоты содержат неполярные радикалы (триптофан и метионин) и полярный неионогенный радикал (серин). Предположительно, ИЭТ пептида =5,7-5,8. 4.Роль серина в формировании пространственной структуры пептидов и белков определяется наличием гидроксогруппы, способной образовывать водородные связи. Водородные связи участвуют в формировании вторичной, третичной и четвертичной структур белков.
4. Нуклеиновые кислоты. Нуклеотидные коферменты
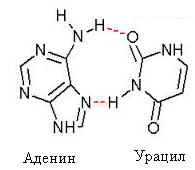
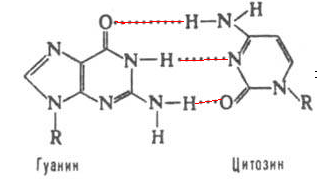
60. Напишите строение гуанина, урацила и комплементарных им оснований. Продемонстрируйте варианты образования водородных связей. Объясните механизм их возникновения. Ответ 1.Строение гуанина, урацила и комплементарных им оснований.
Урацил комплементарен аденину, гуанин –цитозину. На схемах указаны варианты образования водородных связей между основаниями. 2.Механизм возникновения водородных связей: атомы водорода, на которых, вследствие разности электроотрицательностейводорода и азота, формируется частичный положительный заряд, притягиваются к атомам кислорода, входящим в состав карбонильных групп и атомам азота, входящим в составгетероциклов. На атомах О и Nсформирована избыточная электронная плотность. Электростатическое притяжение противоположно заряженных частиц приводит к образованию водородной связи.
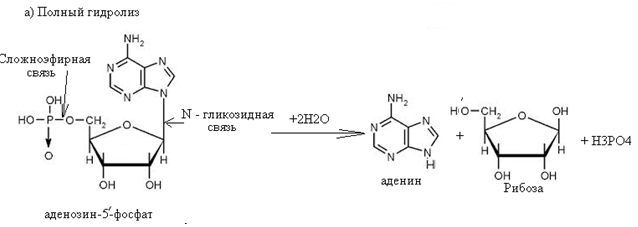
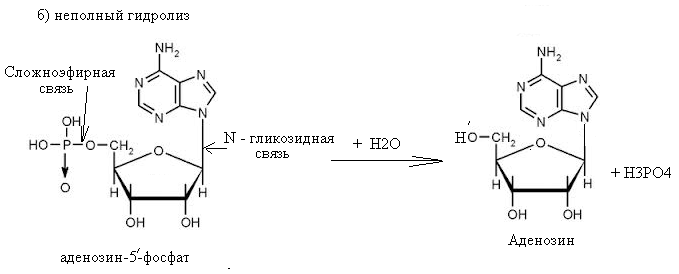
61. Напишите схемы полного и неполного гидролиза аденозин-5'-фосфата. Выделитесложноэфирную и гликозидную связи. Назовите продукты реакций. Укажите механизм реакций. Ответ
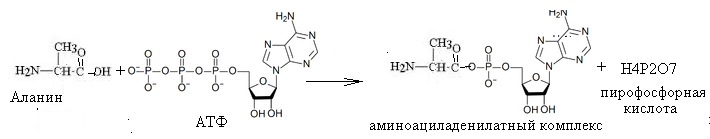
Аденозин-5'-фосфат легко гидролизуется под влиянием слабых кислот при нагревании. При этом образуется аденозин, рибоза и фосфорная кислота. При неполном гидролизе могут образовываться различные продукты, в том числе аденозин и ортофосфорная кислота. 62. Напишите схему взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса). Назовите биологическую роль этого процесса. Ответ Схема взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса).
2.Биологическая роль этого процесса–активирование аминокислоты для реакции биосинтеза. 63. Напишите строение антикодона в т-РНК, соответствующего кодону УГУ в и-РНК. Ответ Антикодоны тРНК комплементарны кодонам иРНК.Т.о. антикодон будет представлен последовательностью нуклеотидов, комплементарных урацилу, гуанину, урацилу. Таковыми нуклеотидами, соотвественно, являются:аденин (А), цитозин(Ц) и аденин (А). т.о., строение антикодона -АЦА
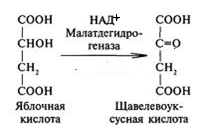
64. Напишите схему превращения яблочной (гидроксибутандиовой) кислоты в щавелевоуксусную (оксобутандиовую) кислоту с участием кофермента НАД+. Укажите биологическое значение реакции. Покажите строение НАД+. Ответ 1.Схема превращения яблочной (гидроксибутандиовой) кислоты в щавелевоуксусную (оксобутандиовую) кислоту с участием кофермента НАД+.
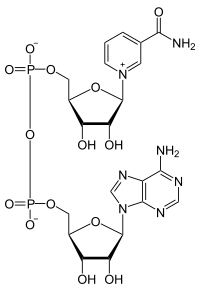
2.Биологическое значение реакции: данная реакция входит в цикл Кребса, в ходе которого осуществляется биологическое окисление субстратов до воды и углекислого газа. 3. Строение НАД+(окисленная форма никотинамидадени́ндинуклеоти́да)
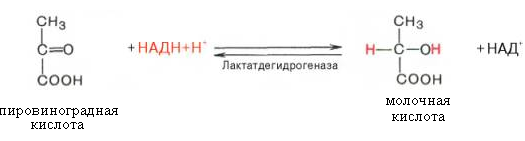
65. Напишите схему реакции превращения пировиноградной кислоты в молочную с участием кофермента НАДН. Объясните возможность протекания обратного процесса. Покажите строение НАДН. Ответ 1.Схема реакции превращения пировиноградной кислоты в молочную с участием кофермента НАДН.
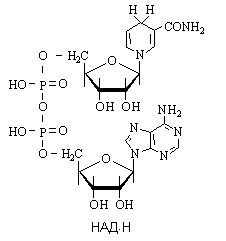
2. Процесс превращения пировиноградной кислоты в молочную протекает в анаэробных условиях. Возможность протекания обратного процесса обусловлена действием фермента лактатдегидрогеназы. 3. Строение НАДН (восстановленная форма никотинамидадени́ндинуклеоти́да)
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 425. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |