
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Модуль 2. «количественный анализ»ЭКЗАМЕНАЦИОННЫЕ ЗАДАЧИ. ОЧНО-ЗАОЧНОЕ, ЗАОЧНОЕ ОБУЧЕНИЕ Модуль 2. «количественный анализ»
1. Из мерной колбы, содержащей 100,00 см3 раствора гидроксида натрия NaOH, отобрали аликвоту – 15,00 см3 раствора. На титрование аликвоты затрачено 18,50 см3 стандартного раствора соляной кислоты НCl с концентрацией с(НCl) = 0,0862 моль/дм3. Рассчитайте молярную концентрацию, титр раствора НCl и массу NaOH, растворенную в мерной колбе. Дано: Решение: V (NaOH)=100 мл NaOH + HCl = NaCl + H2O V (NaOH)=15 мл C (NaOH)= C(HCl) * V (HCl) : Va (NaOH)=0.0862моль/л*18.50мл : 15мл = V (HCl)=18.50 мл = 0.1063моль/л C (HCl)=0.0862 моль/л Т (HCl)= C (HCL) * M (HCl) : 1000= 0.0862 моль/л*36.5г/моль : 1000= Найти: = 0.003146 г/мл С (NaOH), Т (HCl), m (NaOH)-? m(NaOH)= C (NaOH)* V (NaOH) * M (NaOH)= 0.003146 моль/л * 0.1 л *40 г/моль= 0.04252г
2. Для определения аммиака в соли аммония из анализируемого раствора объемом 100,00 см3, содержащем соль аммония, отобрали аликвоту — 10,00 см3 и прибавили к ней избыток раствора формальдегида. Кислоту, образовавшуюся при реакции формальдегида с катионами аммония по схеме 4NH4+ + 6Н2СО → (СН2)6N4 + 4H+ + 6Н2О в количестве, эквивалентном количеству прореагировавших катионов аммония, оттитровали стандартным раствором гидроксида натрия объёмом 9,00 см3 с концентрацией 0,1000 моль/дм3. Рассчитайте концентрацию, титр и массу аммиака (входящего в катионы аммония) в анализируемом растворе. 
3. Для определения NH3 в NH4Cl приготовили раствор хлорида аммония объёмом 100,00 см3, содержащий растворенный образец массой 0,5225 г. Отобрали аликвотную часть V(NH4Cl)=15,00 см3 раствора и прибавили к ней избыточный по сравнению со стехиометрическим объём щелочи V(NaOH)=20,00 см3 стандартного раствора NaOH с c (NaOH)=0,1012 моль/дм3. Осторожно нагрели раствор до полного удаления NH3 по реакции: NH4Cl + NaOH →NH3 ↑ + NaCl + H2O. После охлаждения раствора избыток щелочи оттитровали стандартным раствором HCl с c(HCl)=0,0998 моль/дм3. Рассчитать c(NH4Cl), Т, массу NH3 и NH4Cl в исходном растворе, а также ω(NH4Cl) в анализируемом образце, если на титрование избыточной щелочи израсходован V(HCl)=6,20 см3.
4. На титрование аликвоты – 20,00 см3 раствора буры с молярной концентрацией с(Na2B4O7) = 0,0500 моль/дм3 затрачено 15,00 см3 титранта – соляной кислоты НСl. Рассчитайте молярную концентрацию и титр раствора соляной кислоты HCl.
5. Раствор серной кислоты H2SO4 объёмом 20,00 см3 с молярной концентрацией эквивалента c(1/z H2SO4)=0,0500 моль/дм3 титруют стандартным раствором гидроксида калия КОН с концентрацией c(1/z КОН)=0,1000 моль/дм3. Найти величину рН раствора при добавлении 19,90 см3титранта.
V(H2SO4)=20 мл С(H2SO4)=0,05 моль/л С(КОН)=0,1моль/л V(КОН)=19,90 мл ___________________ Ph-? Решение : H2SO4+2КОН=К2SO4+2Н2О Fэ(H2SO4)=1/2 Fэ (КОН)=1 n(1/2H2SO4)=n(КОН) С(1/2 H2SO4)*V(H2SO4)=C(КОН)*V(КОН) V(КОН)= С(1/2 H2SO4)*V(H2SO4)/С(КОН)=0,05моль/л*20мл/0.1 моль/л= 10 мл С(КОН)ост= С(КОН)*V(КОН)-С(H2SO4)*V(H2SO4)/V(H2SO4)+V(КОН)= 0.1моль/*19,9мл-0,05 моль/л *20 мл/20 мл+19,9мл=0,0248 моль/л КОН=К++ОН- рОН=-lg[ОН-]=-lg0,0248=2-lg2,48=1,605 рН+рОН=14 рН=14-рОН рН=14-1,605=12,395 Среда щелочная
6. Из анализируемого раствора пероксида водорода Н2О2 объёмом 50,00 см3 отобрали аликвотную часть 10,00 см3, прибавили к ней разбавленную серную кислоту H2SO4 и избыток раствора иодида калия KI. Выделившийся I2 оттитровали стандартным раствором тиосульфата натрия Na2S2O3 объёмом 8,00 см3 с концентрацией c(Na2S2O3)=0,0500 моль/дм3. Рассчитайте концентрацию, титр и массу пероксида водорода Н2О2 в анализируемом растворе. Задача № 6 Дано: Решение: V(H2O2)=50ml I H2O2+KJ+H2SO4=K2SO4+J2+2H2O Va(H2O2)=10ml I H2O2+2H+2e→2H2O V(Na2S2O3)=8ml I 2J—2e→J2 C(Na2S2O3)=0,05моль/л I выделивш-я J титруют йодометрич.методом ------------------------------------- J2+ Na2S2O3=NaJ+Na2S4O6 С,Т,m-? 2S2O3-2e→S4O6 n(1/2 H2O2)= n(1/2 J2)=n(Na2S2O3) C(1/2 H2O2)∙V(H2O2)=C(Na2S2O3)∙V(Na2S2O3) C(1/2 H2O2)= C(Na2S2O3)∙V(Na2S2O3)/ V(H2O2) C(1/2 H2O2)=0,05моль/л∙0,008л/0,01л=0,04моль/л m(H2O2)= C(1/2 H2O2)∙M(1/2 H2O2)∙ V( H2O2) m(H2O2)=0,04моль/л∙17г/моль∙0,05л=0,034г T(H2O2)= C(1/2 H2O2)∙ M(1/2 H2O2)/1000 T(H2O2)=0,04моль/л∙17г/моль/1000=0,00068г/мл
7. Какой объем раствора перманганата калия КМnО4 с молярной концентрацией эквивалента cэ(КМnО4) = 0,1000 моль/дм3 и воды требуется для получения 100,00 см3 раствора КМnО4 с титриметрическим фактором пересчета по пероксиду водорода Н2О2 t(KMnO4/Н2О2) = 0,000850 г/см3. Рассчитайте титр полученного раствора КМnО4.
8. Для перманганатометрического определения пероксида магния MgO2 приготовили 10,00 см3 раствора, в котором была растворена навеска анализируемого образца массой 0,2045 г. На титрование приготовленного раствора израсходовано 19,75 см3 стандартного раствора перманганата калия KMnO4 с титриметрическим фактором пересчета по пероксиду магния, равным 0,002816 г/см3. Рассчитайте массу и массовую долю пероксида магния в препарате.
Задача № 8 Дано: Решение: V(MgO2)=10ml I 2KMnO4+5MgO2+8H2SO4=2MnSO4+K2SO4+5 MgSO4+ O2+8H2O m(MgO2)=0,2045г I MnSO4+8H-5e→Mn+4H2O I 5 I 2 V(KMnO4)=19,75ml I MgO2-2e→+ O2+Mg I 2 I 5 t(KMnO4/MgO2)=0,002816г/мл I n(1/2MgO2)= n(1/5KMnO4) ---------------------------------------- C(1/2MgO2)∙V(MgO2)= C(1/5KMnO4)∙V(KMnO4) m,w(MgO2)-? t(KMnO4/MgO2)= C(1/5KMnO4)∙ M(1/2MgO2)/1000 C(1/5KMnO4)= t(KMnO4/MgO2)∙1000/ M(1/2MgO2) C(1/5KMnO4)= 0,002816г/мл∙1000/28 г/моль=0,1006моль/л C(1/2MgO2)= C(1/5KMnO4)∙ V(KMnO4)/ V(MgO2) C(1/2MgO2)=0,1006моль/л∙19,75мл/10мл=0,1987моль/л C(1/2MgO2)= n(1/2MgO2)/ V(MgO2)= m(MgO2)/ M(1/2MgO2)∙ V(MgO2) m(MgO2)= C(1/2MgO2)∙ M(1/2MgO2)∙ V(MgO2) m(MgO2)=0,1987моль/л∙28г/моль∙0,01л=0,0556г w(MgO2)= m(MgO2)/ m(MgO2)∙100% w(MgO2)=0,0556/0,2045∙100%=27,19%
9. Для определения аскорбиновой кислоты в лекарственном препарате иодометрическим методом приготовили 125,00 см3 раствора, содержащего 0,4025 г препарата, и оттитровали его 45,40 см3 стандартного раствора иода с титриметрическим фактором пересчета по аскорбиновой кислоте, равным 0,008806 г/см3. Рассчитайте массу и массовую долю аскорбиновой кислоты в препарате. Поскольку титриметрический фактор пересчёта – это масса определяемого вещества (в данном случае – аскорбиновой кислоты), реагирующая с 1 мл титранта, то общая масса аскорбиновой кислоты m (ас. кис.) равна:
m (ас.кис.) = t (I2/аскорбиновая кислота)V = 0,008806 г/см3 × 45,4 см3 = 0,3998г
Массовая доля аскорбиновой кислоты:
W, % =
10. Для определения меди (II) методом заместительного (косвенного) титрования из анализируемого раствора соли меди (II) объемом V=100,00 см3 отобрали аликвотную часть 15,00 см3, прибавили к ней разбавленную серную кислоту и избыток (по сравнению с ожидаемым стехиометрическим количеством) раствора йодида калия. Йод, выделившийся при реакции с медью (II), оттитровали стандартным раствором тиосульфата натрия объёмом 6,00 см3 с концентрацией 0,0500 моль/дм3. Рассчитайте молярную концентрацию эквивалента, титр и массу меди (II) в анализируемом растворе.
CuO +H2SO4 = CuSO4+H2O 2CuSO4+ 4 KI= 2K2SO4+2I2+Cu2 I2+2Na2S2O3= 2 NaI+Na2S4O6 fэкв=1 n(Cu2+)=n(1/2I2)=n(Na2S2O3) C(Cu2+)*V(Cu2+)=C(Na2S2O3)*V(Na2S2O3) C(Cu)=(C(Na2S2O3)*V(Na2S2O3))/V(Cu)=(0.05моль/л*0,006л)/0,015л=0,02моль/л T(Cu)=(C(Cu)*M(Cu))/1000=(0.02моль/л*64г/моль)/1000=0,00128г/мл m(Cu)=C(Cu)*M(Cu)*V(Cu)=0.02моль/л*64г/моль*0,1л=0,128г
11. Из исходного анализируемого раствора иодида калия объемом 100,00 см3 отобрали аликвоту 20,00 см3 и оттитровали 0,0238 моль/дм3 раствора нитрата серебра в присутствии адсорбционного индикатора эозината натрия до окрашивания осадка в красный цвет. На титрование израсходовали 19,68 см3 раствора нитрата серебра. Определите концентрацию, титр и массу йодида калия в исходном анализируемом растворе.
Дано: Решение: KI + AgNO3=AgI + KNO3 V (KI) = 100 мл n (KI) =n (AgNO3) Vк =20мл C (KI) * V(KI) = C (AgNO3) * V(AgNO3) С (AgNO3)= 0.0238 моль/л C(KI)= C(AgNO3) * V (AgNO3) : V (KI) = 0,0238 моль/л * 0.01969л :0.02л= V (AgNO3)= 19.68 мл = 0.02342 моль/л Найти: T (KI)= C(KI) * М (KI) : 1000= 0.02342 моль/л * 166 г/моль : 1000= С (KI), T (KI), m (исх)-? = 0.003888 г/мл m (KI)= C (KI)* M(KI) * Vк m (исх)= 0.02342 моль/л * 166 г/моль * 0.1л=0.3888г М (KI) =166 г/моль
12. Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, титр и титриметрический фактор пересчета по мышьяку (III) раствора бромата калия КВrО3, полученного растворением 0,0278 г КВrО3 в 100,00 см3 воды и предназначенного для дихроматометрического определения мышьяка (III).
13. Для определения фенола в растворе к 20,00 см3 его добавили избыток КВr, НС1 и 25,00 см3 раствора КВrО3 с титром 0,002836 г/см3. По окончании бромирования (продукт трибромфенол) ввели KI и выделившийся йод оттитровали 5,15 см3 0,1000 моль/дм3 (К=0,8915) раствора Na2S2O3. Рассчитать содержание фенола в растворе в мг/см3.
14. Для определения фенола к его раствору объёмом 20,00 см3 добавили избыток бромида калия KBr, соляную кислоту HCl и 25,00 см3 раствора бромата калия KBrO3 с титром 0,002836 г/см3. По окончании бромирования (продукт - трибромфенол) ввели иодид калия KI и выделившийся йод оттитровали 5,15 см3 0,1000 моль/дм3 (К=0,8915) раствора тиосульфата натрия Na2S2O3. Рассчитать содержание фенола в растворе в мг/см3.
20мл Т(KBrO3)=25мл Т(KBrO3)= 0,002836 v(Na2S2O3)= 5,15мл Кп=0,8915 С(Na2S2O3)=0,1 моль/л Найти: Т(ф)- ? мг/мл
Решение 1) KBrO3 +5KBr+6HCI=3Br2 +6HCI +3H2O
2)
3)Br2+2KY → 2KBr+Y2 Br02+2e →2Br- f(экв. Br2)=1|2
4)Y2+ Na2S2O3→2NaY+Na2S4O6 Y20+2e →2Y- f'экв(Y2)= 1|2
2S2O3-2 -2e → S4O62- fэкв(Na2S2O3)=1
по реакциям: 1 n (1|6 KBrO3) = n(1|2Br2) 2,3 n(1|2Br2)=n(1|6p)+n(1|2 Y2)
4 n(1|2Y)=n (Na2S2O3)
15. При бромометрическом определении резорцина С6Н6О2 (М=110,11 г/моль) с иодометрическим окончанием исходную навеску анализируемого препарата массой 0,1842 г растворили в 100,00 см3 воды. Из полученного раствора отобрали аликвоту 20,00 см3, прибавили 40,00 см3 стандартного раствора бромата калия с молярной концентрацией эквивалента 0,1000 моль/дм3, раствора бромида калия, серную кислоту и через ~15 минут – раствор иодида калия. Выделившийся иод через ~10 минут оттитровали стандартным 0,1000 моль/дм3 раствором тиосульфата натрия V=36,67 см3. Рассчитайте массу и массовую долю резорцина в исходной навеске препарата.
Дано: m ( Резорцина)-0,1842 г v (Р) -100мл а- 20мл с ( 1/6 КBrО3)-0,1 моль/л v (КBrO3)-40мл с(Na2S2O3)-0,1моль/л v(NA2S2O3)-36.67 мл Найти:m,w -? Решение: КBrO3+ 5 КBr + 3H2SO4----3Br2+3H2SO4+3H2O BrO3+6H+6е---Br+3H2O fэкв.=1/6 3е-6е—3с 2КJ+Br2—2КВr+J2 J2+Na2S2O3—NaJ+Na2S4O6 S2O3-2е—S4O6 Fэкв (Na2S2O3)=1 n(1/6КBrO3)=n(1/6P)+n(1/2J2) n(J2)=n(Na2S2O3) n(1/6КBrO3)= n(1/6P)-n(Na2S2O3) n(1/6P)=n(1/6КBrO3)-n(Na2S2O3) V(1/6P)×C(1/6P)=C(1/6КBrO3)×V(КBrO3)-V(Na2S2O3)×C(Na2S2O3) C(1/6P)=C(1/6КBrO3)×V(КBrO3)-C(Na2S2O3)×V(Na2S2O3)÷V(1/6P) C(1/6P)=0.1моль/л×40мл-0,1 моль/л×36,67мл÷20мл=0,01665 m(1/6P)=C(1/6P)×M(1/6P)×Vколб M(P)=110 M(1/6P)=110÷6=18.33г/моль m (1/6P)=0.01665×18.33×0.1=0.0305г W%(1/6P)=m÷m.исход×100% W%(1/6P)=0.0305г÷0,1842×100%=16,56%
16. Навеску лекарственного препарата тимола CH3(C3H7)C6H3OH (М=150,21 г/моль) массой 1,00 г растворили в мерной колбе вместимостью 250,00 см3 и довели объём до метки. К 20,00 см3 полученного раствора добавили 50,00 см3 раствора бромат-бромида с с(1/6 KBrO3)=0,09815 моль/дм3, избыток которого оттитровали иодометрически, затратив 27,15 см3 раствора тиосульфата натрия Na2S2O3 с концентрацией с(Na2S2O3)=0,1049 моль/дм3. Вычислите массовую долю (%) тимола в анализируемом образце.
Дано: m (тимола)=1гр Vколб=250мл Va=20мл V(КBrO3)=50мл С(1/6КBrO3)=0.09815моль/л V(Na2S2O3)=27.15мл С(Na2S2O3)=0.1049МОЛЬ/Л Решение: КBr+5КBr+6HCl—6КCl+3Br2+3H2O BrO3+6H+6е---Br+3H2O 2c-4е—2c fэкв(тимол)=1/4 2КJ+Br2---2КBr+J2 Na2S2O3+J2---NaJ+Na2S4O6 2S2O3-2е----S4O6 fэкв=1 n (1/6КBrO3)=n(1/2Br2)=n(1/4 тимол)+n(1/2J2) n (1/2J2)=n(Na2S2O3) n (1/6 КBrO3)=n(1/4тимол)+n(Na2S2O3) n (1/4тимол)=n(КBrO3)-n(Na2S2O3) C(1/4тимо)×V(ТИМОЛ)=С(КBrO3)×V(КBrO3)-C(Na2S2O3)×V(Na2S2O3) C(1/4тимол)=С(1/6КBrO3)×V(КBrO3)-C(Na2S2O3)×V(Na2S2O3) C(1/4тимол)=0,09815×50-0,1049×27,15÷20мл=0,10297 моль/л M(1/4тимол)=150,21÷4=37,55 г/моль m (тимол)=C×M×Vколб=0,10297×37,55 г/моль×0,25=0,9667г W%(тимол)=0,9667÷1×100%=96,67%
17. Для броматометрического определения As2O3 в препарате мышьяковистого ангидрида приготовили 60,00 см3 раствора, в котором была растворена навеска массой 0,1014 г. На титрование 20,00 см3 этого раствора израсходовано 6,80 см3 стандартного раствора бромата калия KBrO3 с титриметрическим фактором пересчёта по As2O3, равным 0,004946 г/см3. Рассчитайте массу навески и массовую долю (в процентах) As2O3 в исходной навеске препарата.
Решение:
n(1\4As2O3)=n (1\6(KBrO3) C(1\4 As2O3) V(As2O3) = C(1\6KBrO3)V(KBrO3) t=(KBrO3\As2O3)=C(1\6KBrO3) * M(1\4As2O3) \1000 = C 1\6KBrO3 = t(KBrO3\As2O3) * 1000 \ M(1\4AsO3) = 0.004946*1000\ 49.5 г\моль = 0,1 моль\л С(1\4As2O3) =C (1\6Bro3)*V(RBrO3) \ V( As2O3)= 0,1 моль*0,0068 / 0,02л=0,034моль\л m(As2O3)=C(1\4AS2O3) * M(1\4As2O3) *Vк=0.34моль * 49.5г\моль *0,06 л= 0,10098 г w = m(As2O3)*100% \ m навески =0,010098 \ 0,1014 *100 = 99,5 %
18. Навеску стрептоцида C6H8N2SO2 массой 1,0000 г растворили в мерной колбе вместимостью 250,00 см3 и объем раствора довели до метки. К аликвоте объёмом 20,00 см3 добавили 50,00 см3 0,09815 моль/дм3 раствора бромат-бромида калия (fэ(KBrO3)=1/6), избыток полученного брома оттитровали иодометрически, затратив 36,05 см3 0,1049 моль/дм3 раствора тиосульфата натрия Na2S2O3 (fэ=1). Рассчитайте массовую долю (%) стрептоцида в анализируемом образце (М=172,21 г/моль).
1. KBrO3 + KBr + HCl = 3 H2O + KBr + KCl BrO3 + 6 H + 6e = Br + 3 H2O fэкв= 1/6 2. 3. Br2 + 2 KJ = 2 KBr + J2 4. S2 + Na2S2O3= NaS + Na2S4O6
2S2O4 – 2e = S4O6 f экв(Na2S4O6) =1
n (1/6 KBrO3) = n (1/2 Br2) n (1/2 Br2) = n (1/2 стрептоц) + n(Na2S2O3) c (1/6 KBrO3) х V (KBrO3) = c (1/4 стрепт) х V (стрепт) + c (Na2S2O3) х V(Na2s2O3)
c(стрепт) = c (1/6 KBrO3) х V (KBrO3) - c (Na2S2O3) х V(Na2s2O3) V (стрепт)
=0,09815моль/л х50 мл – 0,1049 моль/л х36,05 мл = 4,9075 – 3,7816= 0,056 моль/л 20 мл 20
m (стреп) = с (1/4 стрепт) х М (1/4 стрепт)хV= 0,05 моль/л х ¼ 172,2 г/мольх 0,25 л = 0,602 г
W(стрепт) = 0,602 г / 1 гх100 %= 60,2 %
19. При бромометрическом определении резорцина С6Н6О2 (молярная масса 110,11 г/моль) с иодометрическим окончанием исходную навеску анализируемого препарата массой 0,1842 г растворили в 100,00 см3 воды. Из полученного раствора отобрали аликвоту 20,00 см3, прибавили 40,00 см3 стандартного раствора бромата калия с молярной концентрацией эквивалента 0,1000 моль/дм3, раствора бромида калия, серную кислоту и через ~15 минут – раствор иодида калия. Выделившийся иод через ~10 минут оттитровали стандартным 0,1000 моль/дм3 раствором тиосульфата натрия V=36,67 см3. Рассчитайте массу и массовую долю резорцина в исходной навеске препарата. Дано: М(C6H6O2) = 110,11 г\моль m=1,1842 V ( H2O) =100ml V аликвоты = 20мл V стнд. (KBr)= 40мл Решение: 1) KBro3+5 KBr+3H2So4 = 3Br2+3K2So4+3H20
2) + 3Br2 = Br Br Br 2 + 3HBr HO HO CH Br
3) Br2+ 2KI - 2KBr +I2 4) I2 +2Na2S2O3 = 2NaI + Na2S4O6 n ( 1\6KBrO3) = n (1\2Br2) n ( 1\2Br2)=n( 1\6p) + n (1\2 I2) n( 1\2 I2) = n ( Na2S2O3) n(1\6KBrO3) = n( 1\6p) +n( Na2S2O3) n=CV C(1\6KBrO3)V(KBrO3)=C( 1\6p)V(p) +C ( Na2S2O3)V(Na2S2O3)
C (1\6p) = C (1\6KBrO3)V(1\6KBrO3)-C(Na2S2O3)V(Na2S2O3)K V(p) C (1\6KBrO3)= 0,1моль\л * 40мл-0,1моль*36,67мл = 0,0166 моль\л 20мл
m(p) = c (1\6p) M(1\6p) Vк = 0.0166*110.11\6 = 0.304*0.1=0.0304 г C 1\6(p) = n(1\6p) \ V(p) = m(p) \ M(1\6p)*V(P) M(p) = C ( 1\6p)M(1\6p) * Vк = 0.01665*18.33*0.1л = 0,03052 M(1\6p) = 110\6= 18/53 г\моль W(1\6p) = M\m * 100%= 0.0305 \ 0.1842= 16.56%
20. Образец препарата викасол C11H9NaO5S∙3H2O массой 0,3005 г перевели в раствор и после его восстановления цинковой пылью в кислой среде полученный раствор, содержащий продукт восстановления викасола, оттитровали стандартным 0,1000 моль/дм3 раствором сульфата церия (IV) в присутствии индикатора ортофенантролина. На титрование анализируемого раствора израсходовано 17,65 см3 титранта с титриметрическим фактором пересчета по викасолу, равным t(Ce4+/викасол) = 0,01652 г/см3. Рассчитайте массу и массовую долю викасола в анализируемом образце препарата (М=330,29 г/моль).
O
|
|||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 3717. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |



 =
=  = 99,33 %
= 99,33 %


 V(тимол)
V(тимол) 3As2O3+2KBrO3+9H2O 6H3AsO4+2KBr
3As2O3+2KBrO3+9H2O 6H3AsO4+2KBr

 3As2O3+H2o-4eH H3AsO4+4H+ 4 2 3 F =1\4
3As2O3+H2o-4eH H3AsO4+4H+ 4 2 3 F =1\4 BrO3+6H +6e Br+3H2O 6 3 2 F = 1\6
BrO3+6H +6e Br+3H2O 6 3 2 F = 1\6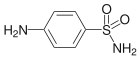 + 2Br2 =
+ 2Br2 = 
 OH OH
OH OH


 O
O 





 CH3 CH3
CH3 CH3


 SO3Na
SO3Na + NaOH + Na2SO4 +H2O
+ NaOH + Na2SO4 +H2O