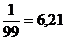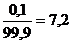Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение индикатора и индикаторной ошибки.Содержание. 1.Задание. 2.Расчет кривой титрования сильной кислоты сильным основанием. 3. Определение индикатора и индикаторной ошибки. 4 Расчет кривой титрования слабой кислоты сильным основанием. 5. Определение индикатора и индикаторной ошибки.
Задание: расчитать и построить кривые титрования в 100 мл. 0,1 молярного раствора HCl 100 мл. 0,1 молярного раствора бензойной кислоты (К
Расчет кривой титрования сильной кислоты сильным основание. HCl- сильная кислота; NaOH- сильное основание.
1.При вычислении значение pH в растворах сильных кислот и оснований, являющихся сильными электролитами, концентрацию ионов Н+ или ОН- принимают практически равной общей концетрации кислот или оснований . Тогда значение рН в исходном растворе кислоты определяется рН=-lg pH=-lg0,1=1 2.Концентрация остаточной кислоты, а, следовательно, и концентрацию ионов водорода в промежуточных точках титрования (до точки эквивалентности) рассчитывается по формуле:
50%: рН=-lg 90%: pH=-lg10-2=2 99%:
рН=-lg10-3=3 99,9%: рН=-lg10-4=4
2.В точке эквивалентности.
рН=7
3. После точки эквивалентности. Теперь проводят расчет концентрации избытка реагента (щелочи):
100,1%: pOH=-lg10-4=4 pH=14-4=10 101%: рОН=-lg10-3=3 pH=14-3=11 110%: рОН=-lg10-2=2  pH=14-2=12
Определение индикатора и индикаторной ошибки. При титровании сильной кислоты сильным основание скачек титрования определяется в 6 единиц рН, от 4 до 9. В этих границах рН свою окраску изменяют многие индикаторы., например, метиловый красный (4,4-6,2). Значит, рТ будет находиться по формуле: рТ= Проанализировав значения в точке эквивалентности (рН=7) и значение рТ=5,3, можно сделать вывод что мы не до титровали, поэтому мы находим кислотную ошибку. ∆НА ∆НА= ∆ОН=
Расчет кривой титрования слабой кислоты сильным основание. 1.До начала титрования, т.е. в чистом растворе одноосновной слабой кислоты концентрации В соответствии с этим константа диссоциации представлена в виде: Кк-ты= рН= рК=-lgKд рК=-lg6,3 pH= 2.В промежуточных точках титрования слабой кислоты сильным основание образуется буферный раствор, содержащий одновременно свободную слабую кислоту и соль этой кислоты. Расчет величины рН в этом случае так же рассчитывается из Кк-ты, которая в присутствии соли может быть представлена в виде: К= рН=рКт-ты-lg 50%: 4,21-lg 90%: 4,21-lg 99%: 4,21-lg 99,9%: 4,21-lg 3.В точке эквивалентности. Образуется соль, гидролиз которой обуславливает щелочную реакцию среды. Значит рН=7+ рН=7+ 4.После точки эквивалентности концентрацию избытка рабочего раствора (щелочи) рассчитывают аналогично расчету точек при f>1 для титрования сильной кислоты сильным основанием, т.к. присутствие сильной щелочи подавляет гидролиз соли, что определяет величину рН в этом случае присутствующей в растворе свободной щелочью. 100,1%: pOH=-lg10-4=4 pH=14-4=10 101%: рОН=-lg10-3=3 pH=14-3=11 110%: рОН=-lg10-2=2 pH=14-2=12
Определение индикатора и индикаторной ошибки.
При титровании слабой кислоты сильным основанием скачек титрования определяется значениями рН в пределах от 7 до 10. В этом пределе свою окраску меняет крезоловый пурпурный, рТ будет находиться по формуле рТ= Проанализировав значения в точке эквивалентности (рН=8,6) и значение рТ=8,2, можно сделать вывод что мы не до титровали, поэтому мы находим кислотную ошибку.
∆НА ∆НА= ∆ОН=
|
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 153. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 10-5). Выбрать индикатор и рассчитать индикаторную ошибку. При расчете кривой титрования необходимо рассчитать начальную точку; 90; 99; 99,9; точку эквивалентности и после точки эквивалентности (101; 110). Кривые титрования строят в одной системе координат.
10-5). Выбрать индикатор и рассчитать индикаторную ошибку. При расчете кривой титрования необходимо рассчитать начальную точку; 90; 99; 99,9; точку эквивалентности и после точки эквивалентности (101; 110). Кривые титрования строят в одной системе координат.

 ; рН=-lg
; рН=-lg 




 =10-7
=10-7 ; рОН=-lg10-4; рН=14-рОН
; рОН=-lg10-4; рН=14-рОН 
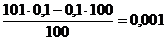


 ; ∆ОН=
; ∆ОН= 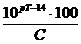


 равны между собой, а концентрация
равны между собой, а концентрация 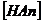 практически равна концентрации исходной кислоты при условии, что степень диссоциации достаточно мала.
практически равна концентрации исходной кислоты при условии, что степень диссоциации достаточно мала.

 =4,21
=4,21