
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет результата прямого титрования при разных способах выражения концентрации раствораТребования к реакции титрования. 1. Реакция д.б стехиометричной идти по определенному урав. С образованием определенного продукта 2. Р д.иметь высокую константу равновесия 3. Высокая скорость реакции 4. Д. существовать способ определения КТТ Титранты, способы их приготовления и стандартизации. 1. По точной навески ве-ва. Способ годится то-ка для первичных стандартов, т.е твердых в-в в высокой степени частоты имеющий определенный хим состав и хим устойчив при хранении в твердом и растворенном виде. 2. Стандартизованный раствор(вторичный стандарт). В начале готовят р-р с приблизительно требуемой конц, затем р-р стандартизуют титруя им станд-ый р-р др ве-ва . точную конц рассчитывают по результатам титрования. 3. По фиксаналу(стандарт-титр)-запаянная ампула с точной отмеренной порцией ве-ва. Обычно фиксанал рассчитан на 1л 0.1 н нормального р-ра. Количественно переносят в литровую мерную колбу растворяют водой и доводят до нужной метки. Точное разбавление имеющегося стандартного р-ра с наиболее высокой конц 10.Классификация титриметрических методов: по способу обнаружения КТТ: 1. Визуальные 1. Индикаторные 2. Безиндикаторные 2.инструментальные(в процессе титрования с помощью анал-ого прибора изменяется аналитический сигнал и строится кривая тирования т.е зависимость сигнала от объема тиранта по кривой титрования находят КТТ). по способу титрования: 1. Прямое 2. Обратное 3. Заместительное По способу отбора проб 1. пипитирования метод аликвот( для анализа берут навеску пробы переносят в широкую колбу и доводятся до метки. На каждой из паралейного тирования мерной пипеткой отбирают одинаковые аликвоты этого р-ра )  2. метод отдельных навесок 11. Молятная концетрация-отношение количества растворенного вещества к объему раствора. Молярная концентрация эквивалента, обозначаемая через с, представляет собой отношение количества вещества эквивалента в системе ( например, в растворе) к объему V этой системы.Молярная концентрация эквивалентов называется нормальной концентрацией.Молярная концентрация эквивалентов растворенного вещества В, символ сэк ( В), представляет собой отношение количества вещества эквивалентов пЭк ( В) к объему раствора VP: сэк ( В) пЭк ( B) / Vp.Если молярная концентрация эквивалента кислоты точно известна, этот раствор можно использовать для установления концентрации щелочи. Так же поступают и при определении концентрации кислоты, если известна концентрация щелочи.Эквивалент – это часть молекулы (атома) вещества, равноценная в химической реакции одному атому или иону водорода или одному электрону. Соответственно, молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль. Расчет результата прямого титрования при разных способах выражения концентрации раствора Обозначения величин, относящихся к раствору определяемого вещества, будем отмечать индексом "1", а к раствору титранта – индексом "2".
Отсюда получаем очень важное уравнение C1V1 = C2V2 .. Если известен объем анализируемого раствора, то по этому уравнению можно рассчитать его концентрацию.
Рабочий раствор в титриметрическом анализе нередко характеризуют молярной концентрацией эквивалента с поправочным коэффициентом. Поправочный коэффициент равен отношению истинной молярной концентрации эквивалента Cист рабочего раствора к округленной табличной молярной концентрации эквивалента Cтабл, для которой заранее рассчитано, какой массе определяемого вещества соответствует данный объем рабочего раствора. Например, 22,50 мл точно 0,1000 н. NaOH нейтрализуют 0,08204 г HCl, а 22,52 мл этой щелочи – 0,08211 г HCl и т.д. Если истинная молярная концентрация эквивалента Cист=0,1048 моль/л, то поправочный коэффициент равен При расчете результатов титрования табличный результат умножают на поправочный коэффициент. Если израсходовано 22,52 мл кислоты, табличный результат равен 0,08211 г и истинная масса кислоты составитm(HCl) = mтабл×K = 0,08211×1,048 = 0,08605 г.Этот способ очень удобен при серийных определениях и широко используется в цеховых и заводских лабораториях.
Тогда масса определяемого вещества в анализируемом растворе будет равна Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора, или титра раствора по определяемому веществу T2/1. Он показывает массу определяемого вещества, которая соответствует 1 мл рабочего раствора. Поэтому масса определяемого вещества может быть рассчитана очень простым образом m1=T2/1×V2 .
Рассмотренными в данном разделе способами рассчитывается результат и в методе титрования по замещению.
Количество вещества эквивалента хлорида в растворе находим из уравненияn(AgCl) = n(AgNO3) – n(AgSCN).Подставим в эту формулу выражения для количества вещества эквивалента Таким образом, результат обратного титрования всегда рассчитывается по разности между взятым количеством вещества эквивалента основного рабочего вещества и оставшимся после его реакции с определяемым компонентом. Метод пипетирования состоит в том, что навеску анализируемого вещества растворяют в мерной колбе, доводят объем водой до метки и берут для титрования определенные ( аликвотные) порции раствора пипеткой.Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок. При использованииметода пипетирования, особенно в случае работы с жидкими веществами, рассчитанную навеску анализируемого образца взвешивают на аналитических весах и помещают в мерные колбы емкостью 50, 100 или 250 мл. Раствор желательно готовить в том растворителе, в среде которого проводят титрование. При анализеметодом отдельных навесок раствор для титрования готовят, растворяя навеску в колбе для титрования. Полученный раствор титруют из бюретки рабочим раствором. Для получения среднего результата нужно взять три отдельные навески, растворить и оттитровать каждую. По среднему результату вычисляют содержание анализируемого вещества в навеске. При этом способе количество вещества в колбе для титрования равно содержанию его в навеске. Здесь упрощается приготовление раствора для титрования, исключаются ошибки, связанные с разбавлением в мерной колбе и отбором пипеткой аликвоты, но затрачивается больше времени на взвешивание. Учащиеся должны освоить приемы подготовки проб обоими способами. Расчет результатов анализа при этих способах различен, на это нужно обратить особое внимание М(fэкв В) = fэкв(В) * М(В) = 1/z*(В)*М(В) Титрование заместителя используют при отсутствии подходящего индикатора, при несоблюдении стехиометричности, при медленном протекании реакции и др. В этом случае к определенному объему А добавляют избыток вспомогательного реагента, стехиометрически взаимодействующего с веществом А, а получающийся в эквивалентном количестве продукт реакции оттитровывают рабочим раствором В. Закон эквивалентов при титровании заместителя имеет выражение, как при прямом титровании:n(А) = n(B) Например, для определения соли аммония проводят реакцию с формальдегидом: 4NH4+ + 6СН2О = (СН2)6N4 + 4H+ + 6Н2O Выделившееся эквивалентное количество ионов H+ (заместителей NH4+) оттитровывают рабочим раствором NaOH. Н+ + OH- = H2O n(NH4+) = n(NaOH) 13. Кислотно-основное титрование - это экспериментальная методика определения концентрации кислоты либо основания, используемая преимущественно в количественном химическом анализе. Обычно кислоту с известной концентрацией постепенно добавляют из бюретки в щелочной раствор неизвестной концентрации, находящийся в конической колбе. Точка эквивалентности титрования достигается в тот момент, когда к основанию добавлено точно стехиометрическое количество кислоты. В этой точке вся щелочь нейтрализована, и в растворе нет ни избытка кислоты, ни избытка основания. При проведении кислотно-основных титрований для определения точки эквивалентности часто пользуются индикаторами. Однако точку эквивалентности можно определять также потенциометрически с помощью рН-метра или кондуктометрическими методами. Титранты и определ.в-ва:Сильные кислоты: HCl,HClO4,H2SO4- сильные и слабые основания:NaOH,NH3,Na2CO3. Сильные основания:NaOH,KOH-сильные и слабые кислоты:HCl,CH3COOH,H3PO4. 17. Индикаторами в методе кислотно-основного титрования служат вещества, меняющие свою окраску при изменении рН среды. Поэтому их называют кислотно-основными, или рН-индикаторами. Наиболее широко используются в анализе: метиловый оранжевый, фенолфталеин, лакмус, метиловый красный, тимолфталеин, бромтимоловый синий. Сделать правильный выбор индикатора для титриметрического анализа можно лишь зная теорию индикаторов. Существует так называемая ионно-хромофорная теория индикаторов, объясняющая свойства таких индикаторов. Согласно ионной теории индикаторы, используемые в методе кислотно-основного титрования, – это слабые органические кислоты (или слабые органические основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску. Индикаторы, обладающие свойством присоединять протоны, называют основными индикаторами (IndOH). Такие индикаторы диссоциируют по схеме IndOH + H+ Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами (HInd). Если упрощенно обозначить молекулы фенолфталеина через HInd, а анионы его – через Ind -, то можно записать следующее уравнение: HInd Согласно хромофорной теории молекулы кислотно-основных индикаторов содержат так называемые хромофоры(носители цветности), т. е. особые группы атомов с сопряженными двойными связями и неподеленными парами электронов:
При изменении рН раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов – результат изменений в их внутреннем строении. У одноцветных индикаторов это связано с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие, имеющих различную окраску. Этот процесс называется таутомерией. Переход из одной таутомерной формы в другую происходит под действием ионов Н+> и ОН-, поскольку одна из форм индикатора является слабой органической кислотой или слабым органическим основанием. На окраску индикаторов влияет также присутствие в соединениях других группировок, называемых ауксохромами. К ним относятся группы -OH, -NH2, -OCH3, -N(CH3)2 и т. д. Ауксохромы сами не сообщают окраску индикаторам, но обладают свойством усиливать действие хромофоров, повышать интенсивность вызываемой ими окраски. Таким образом, в растворах кислотно-основных индикаторов одновременно происходят как равновесные процессы, обусловленные диссоциацией молекул, так и равновесные процессы, связанные с внутримолекулярной группировкой. Свойство молекул различных индикаторов диссоциировать в нейтральной среде характеризуется константами диссоциации. Например, у метилового оранжевого
С учетом того, что обычно способность человека к восприятию окраски возможна, когда присутствие одной из окрашенных форм приблизительно в 10 раз больше концентрации другой, получим
т. е. интервал значений рН, в пределах которого индикатор изменяет свою окраску, простирается обычно на одну единицу рН в ту или другую сторону от величины рК индикатора. Этот интервал перехода окраски индикатора называют также областью перехода. В Приложении 5 указаны интервалы перехода окраски некоторых индикаторов. Например, область перехода метилового оранжевого простирается от 3,1 до 4,4. При рН > 4,4 метилоранж сохраняет желтую окраску, при рН < 3,1 – розовую. Внутри этого интервала происходит изменение окраски от розового цвета до желтого. В ходе титрования раствор титранта приливают до отчетливого изменения окраски индикатора. Значение рН, при котором наблюдается резкое изменение окраски индикатора, называют показателем титрования рТ. Например, у фенолфталеина значение рТ = 9, у метилового оранжевого рТ = 4. Обычно величина рТ находится внутри интервала перехода.Для того чтобы погрешность титрования была наименьшей, надо чтобы изменение окраски индикатора происходило как можно ближе к точке эквивалентности (т. е. конечная точка титрования как можно больше соответствовала точке эквивалентности). Неправильный выбор индикатора может исказить результат анализа. Чтобы этого не произошло, необходимо в каждом определении представлять, каким образом происходит изменение рН в процессе титрования, в какой среде лежит точка эквивалентности, как резко изменяется рН вблизи точки эквивалентности. Эти процессы описывают кривые титрования.При выборе индикатора руководствуются следующим правилом: для каждого данного титрования можно применять только те индикаторы, показатели титрования которых лежат в пределах скачка рН на кривой титрования, т. е. у правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования на данной кривой. 19Основные (протофильные) растворители - соединения основного характера, являющиеся акцепторами протонов. К этой группе растворителей принадлежат: жидкий аммиак, пиридин, диметил-формамид, формамид, этилендиамин. Амфипротные (амфотерные) растворителиобладают как кислотными, так и основными свойствами. Эта группа раствори-телей представлена спиртами (метанол, этанол и др.), кетонами (метилэтилкетон, ацетон и др.). Дифференцирующие растворители увеличивают различия в силе электролитов. К этой группе растворителей принадлежат: метил-этилкетон, ацетон, метанол, нитрометан и др. В нивелирующих растворителях электролиты хорошо и примерно одинаково диссоциируют, потому эти растворители уравнивают различия в силе кислот или оснований. Основные растворители (например, жидкий аммиак) являются нивелирующими для кислот, а кислотные растворители (например, жидкий хлороводород) уравнивают силу оснований. Кислотно-основное титрование в неводных средах позволяет существенно расширить возможности метода. Им определяют сильные, слабые и очень слабые кислоты (индивидуальные вещества, смеси веществ), основания, соли. Метод широко используют в практике фармацевтического анализа для определения разнообразных лекарственных препаратов, которые малорастворимы в воде, проявляют свойства очень слабых кислот или оснований. Конечную точку титрования в неводных растворителях фиксируют с использованием кислотно-основных индикаторов или при помощи инструментальных методов. Выбор индикатора осложняется тем, что основные параметры, характеризующие кислотно-основный индикатор (такие как рКинд, показатель титрования рТ, интервал перехода рН и окраска индикатора), различны в различных растворителях и сильно отличаются от их значений в воде. Поэтому выбор индикаторов для определения веществ в неводных растворителях проводится чаще эмпирически. Для определения кислот используют индикаторы: азофиолетовый, тимолфталеин, тимоловый синий, нейтральный красный. Для определения оснований применяют кристаллический фиолетовый, диметиловый желтый и др. Однако конечную точку титрования наиболее точно определяют электрометрическими методами анализа - потенциометрическим или кондуктометрическим. |
||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 231. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
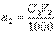 Если известны молярная концентрация эквивалента (нормальность) титранта C2 и объем раствора V2 в миллилитрах, израсходованный на титрование определяемого вещества, то количество вещества титранта, затраченное на реакцию, будет равно
Если известны молярная концентрация эквивалента (нормальность) титранта C2 и объем раствора V2 в миллилитрах, израсходованный на титрование определяемого вещества, то количество вещества титранта, затраченное на реакцию, будет равно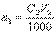 В точке эквивалентности количество вещества титранта, израсходованное на реакцию, будет точно равно количеству определяемого вещества в анализируемом растворе (n1=n2).
В точке эквивалентности количество вещества титранта, израсходованное на реакцию, будет точно равно количеству определяемого вещества в анализируемом растворе (n1=n2).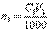 Количество определяемого вещества (в молях эквивалента), находящееся в анализируемом растворе, можно также представить соотношением
Количество определяемого вещества (в молях эквивалента), находящееся в анализируемом растворе, можно также представить соотношением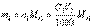 Масса m1 определяемого вещества в анализируемом растворе рассчитывается по соотношению где Mэ1 – молярная масса эквивалента определяемого вещества.Например, пусть раствор соляной кислоты титруют раствором NaOH с молярной концентрацией эквивалента C(NaOH)=0,1048 моль/л,и на титро-ие израс-но V(NaOH)=22,52 мл этого раствора. Тогда
Масса m1 определяемого вещества в анализируемом растворе рассчитывается по соотношению где Mэ1 – молярная масса эквивалента определяемого вещества.Например, пусть раствор соляной кислоты титруют раствором NaOH с молярной концентрацией эквивалента C(NaOH)=0,1048 моль/л,и на титро-ие израс-но V(NaOH)=22,52 мл этого раствора. Тогда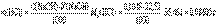
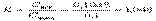 .
.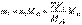
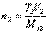 Если известен титр T2 рабочего раствора, т.е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента титранта, вступившее в реакцию, составит
Если известен титр T2 рабочего раствора, т.е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента титранта, вступившее в реакцию, составит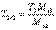 Если сравнить это выражение с предыдущей формулой расчета по титру рабочего раствора, то титр по определяемому веществу можно представить в виде
Если сравнить это выражение с предыдущей формулой расчета по титру рабочего раствора, то титр по определяемому веществу можно представить в виде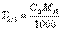 С другой стороны, из формулы расчета массы определяемого вещества через молярную концентрацию эквивалента рабочего раствора следует, что
С другой стороны, из формулы расчета массы определяемого вещества через молярную концентрацию эквивалента рабочего раствора следует, что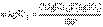 Расчет результата в методах обратного титрования Рассмотрим расчет результата на примере обратного титрования хлорида. В этом случае к анализируемому раствору хлорида добавляется заведомый избыток титрованного раствора AgNO3, и не вступившее в реакцию с хлоридом количество вещества AgNO3 оттитровывается растворомNH4SCN. Если n(AgNO3) – количество вещества AgNO3, добавленное к анализируемому раствору хлорида, n(AgCl) – количество вещества эквивалента AgNO3, израсходованное на реакцию с хлоридом, а n(AgSCN) – на реакцию с тиоцианатом, то, очевидно,n(AgNO3) = n(AgCl) + n(AgSCN).Величина n(AgNO3) определяется молярной концентрацией эквивалента основного рабочего раствора AgNO3 и его объемом Молярная концентрация эквивалента вспомогательного рабочего раствора NH4SCN и его объем, затраченный на реакцию с избытком AgNO3после осаждения хлорида, точно известны, поэтому
Расчет результата в методах обратного титрования Рассмотрим расчет результата на примере обратного титрования хлорида. В этом случае к анализируемому раствору хлорида добавляется заведомый избыток титрованного раствора AgNO3, и не вступившее в реакцию с хлоридом количество вещества AgNO3 оттитровывается растворомNH4SCN. Если n(AgNO3) – количество вещества AgNO3, добавленное к анализируемому раствору хлорида, n(AgCl) – количество вещества эквивалента AgNO3, израсходованное на реакцию с хлоридом, а n(AgSCN) – на реакцию с тиоцианатом, то, очевидно,n(AgNO3) = n(AgCl) + n(AgSCN).Величина n(AgNO3) определяется молярной концентрацией эквивалента основного рабочего раствора AgNO3 и его объемом Молярная концентрация эквивалента вспомогательного рабочего раствора NH4SCN и его объем, затраченный на реакцию с избытком AgNO3после осаждения хлорида, точно известны, поэтому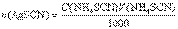 .
.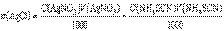 Масса хлорида в анализируемом растворе будет равна
Масса хлорида в анализируемом растворе будет равна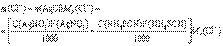
 Ind+ + H2O (12.2.1)
Ind+ + H2O (12.2.1)
 , у фенолфталеина
, у фенолфталеина  .Взаимосвязь между константой диссоциации индикатора и значением рН, где происходит изменение его окраски, можно вывести из общих соображений диссоциации индикатора (уравнение (12.2.2)) с учетом З.Д.М. для равновесных концентраций:
.Взаимосвязь между константой диссоциации индикатора и значением рН, где происходит изменение его окраски, можно вывести из общих соображений диссоциации индикатора (уравнение (12.2.2)) с учетом З.Д.М. для равновесных концентраций: (12.2.3)
(12.2.3) 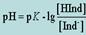 (12.2.4)
(12.2.4)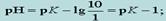
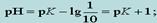
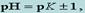 (12.2.5)
(12.2.5)