
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Что такое газовые смеси? Сформулировать и объяснить закон Дальтона.Филиал ФГБОУ ВПО «Мурманский государственный технический университет»
Контрольная работа №1
Дисциплина/Профессиональный модуль (МДК/Раздел) ОП.07. Техническая термодинамика и теплопередача Специальность:26.02.05. Эксплуатация судовых энергетических установок Вариант № 9
АРХАНГЕЛЬСК 2018 ОГЛАВЛЕНИЕ
Введение. 3 1. Задача. 4 2. Задача. 5 3. Задача. 6 4. Дать краткую характеристику основных термодинамических процессов. 7 Изохорный процесс. 7 Изобарный процесс. 9 Изотермический процесс. 10 Адиабатный процесс. 11 Политропный процесс. 13 5. Что такое газовые смеси? Сформулировать и объяснить закон Дальтона. 15 Заключение. 16 Список рекомендуемой литературы.. 17
Введение
Техническая термодинамика занимается изучением физических явлений, связанных с превращением теплоты в работу и работы в теплоту в тепловых машинах (паровых и газовых турбинах, двигателях внутреннего сгорания, холодильных установках). Это наука является частью более общей науки – термодинамики, в которой изучаются разнообразные явления природы: физические, космические, химические, биологические и другие – в свете двух фундаментальных законов природы: Первого и Второго начал термодинамики Зарождение технической термодинамик было обусловлено появлением в конце ⅩⅤⅢ столетия паровых машин.  Постепенно область применения паровых машин расширялась и повлекло за собой дальнейшее развитие этой науки, связанное с усовершенствованием паровых двигателей и созданием новых типов, более экономичных паровых машин и паровых турбин, что в свою очередь дало более глубокие исследования тепловых процессов, протекающих в данных устройствах, которые позволили резко снизить удельный расход топлива, примерно в 25 раз (по сравнению с расходом первых паровых двигателей) Ещё на рубеже ⅩⅠⅩ и ⅩⅩ вв. немецкий инженер Р. Дизель провёл термодинамические исследования, которые позволили ему создать в 1898 г. новый тип двигателя внутреннего сгорания, значительно более экономичный, чем паровые машины того времени, названный в честь его изобретателя дизелем. Развитее тепловых двигателей в свою очередь ставило перед технической термодинамикой новые задачи, решение которых способствовало её дальнейшему развитию. В настоящее время ведутся интенсивные термодинамические исследования по прямому преобразованию теплоты в электрическую энергию, минуя промежуточную стадию – превращение теплоты в механическую работу, в тепловых двигателях. Термодинамические исследования установок по прямому превращению теплоты в электроэнергию являются ещё одним шагом вперёд в развитии технической термодинамики. Таким образом, развитие термодинамики и тепловых машин тесно связано.
Задача Определить абсолютное давление в паровом котле, если манометр показывает 0,245 МПа, а атмосферное давление по ртутному барометру составляет 700 мм рт. ст. при температуре 20 кДж/(кг·К).
Задача
Какой объем занимает 1 кг азота при температуре 70°С и давлении 0,2 МПа?
Задача
2 м3 воздуха с начальной температурой 15°С расширяются при постоянном давлении вследствие сообщения газу 837 кДж теплоты. Среднюю объемную изобарную теплоемкость принять равной 1,287 кДж/(кг·К). Найти конечный объем газа.
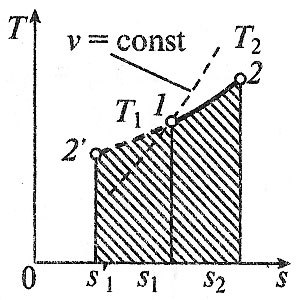
Дать краткую характеристику основных термодинамических процессов. Основными процессами в термодинамике являются: § изохорный, протекающий при постоянном объеме; § изобарный, протекающий при постоянном давлении; § изотермический, происходящий при постоянной температуре; § адиабатный, при котором теплообмен с окружающей средой отсутствует; § политропный, удовлетворяющий уравнению pvn= const. Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса. При исследовании термодинамических процессов определяют: § уравнение процесса в p—v иT—s координатах; § связь между параметрами состояния газа; § изменение внутренней энергии; § величину внешней работы; § количество подведенной теплоты на осуществление процесса или количество отведенной теплоты. Изохорный процесс Изохорный процесс в p, v—, T, s— и i, s-координатах (диаграммах) При изохорном процессе выполняется условие v = const. Из уравнения состояния идеального газа (pv = RT) следует: p/T = R/v = const, т. е. давление газа прямо пропорционально его абсолютной температуре: p2/p1 = T2/T1. Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const). Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле: q= cv(T2 — T1). Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле: Δu = cv(T2 — T1). Изменение энтропии в изохорном процессе определяется по формуле: s2 – s1= Δs = cvln(p2/p1) = cvln(T2/T1). Изобарный процесс
Изобарный процесс в p, v—, T, s— и i, s-координатах (диаграммах) Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа следует: v/T = R/p = const или v2/v1 = T2/T1, т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре. Работа будет равна: l = p (v2 – v1). Т. к. pv1 = RT1 и pv2 = RT2, то l = R (T2 – T1). Количество теплоты при cp = const определяется по формуле: q = ср. (T2 – T1). Изменение энтропии будет равно: s2 – s1= Δs = cpln(T2/T1).
Изотермический процесс
Изотермический процесс в p, v—, T, s— и i, s-координатах (диаграммах) При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно: pv = RT = const или p2/p1 = v1/v2, т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается. Работа процесса будет равна: l = RTln (v2 – v1) = RTln (p1 – p2). Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения: q = l. При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе. Изменение энтропии равно: s2 – s1= Δs = Rln(p1/p2) = Rln(v2/v1). Адиабатный процесс
Адиабатный процесс в p, v—, T, s— и i, s-координатах (диаграммах) Адиабатным называется процесс изменения состояния газа, который происходит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид: du + pdv = 0 или Δu+ l = 0, следовательно Δu= —l. В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа. Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом: dq = cадdT = 0. Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0). Известно, что сp/cv = k и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид: pvk = const. В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона). Значения показателя адиабаты k для некоторых газов: kвоздуха = 1,4 kперегретого пара = 1,3 kвыхлопных газов ДВС = 1,33 kнасыщенного влажного пара = 1,135 Из предыдущих формул следует: l= — Δu = cv (T1 – T2); i1 – i2= cp (T1 – T2). Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2). Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T,s-диаграмме он изображается вертикальной линией. Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds> 0, и процесс называется реальным адиабатным процессом. Политропный процесс Политропным называется процесс, который описывается уравнением: pvn= const. Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной. Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе: p2/p1 = (v1/v2)n; T2/T1 = (v1/v2)n-1; T2/T1 = (p2/p1)(n-1)/n. Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать: Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики: q = (u2 – u1) + l. Поскольку
представляет собой теплоемкость идеального газа в политропном процессе. При cv, k и n = const cn = const, поэтому политропный процесс иногда определят, как процесс с постоянной теплоемкостью. Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов. Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv0 = const (n = 0) – изобара; pv = const (n = 1) – изотерма; p0v = const, p1/∞v = const, pv∞ = const – изохора; pvk = const (n = k) – адиабата. n> 0 – гиперболические кривые, n <0 – параболы.
Что такое газовые смеси? Сформулировать и объяснить закон Дальтона. В термодинамических расчетах реальные газы, входящие в состав газовой смеси с относительно невысоким давлением, рассматриваются как идеальные газы, при этом и сама газовая смесь тоже рассматривается как идеальная. Такое допущение дает возможность при расчетах газовых смесей пользоваться законами идеальных газов, в частности законом Дальтона, который лежит в основе изучения газовых смесей.
Давление газовой смеси (p) равно сумме парциальных давлений ее компонентов: Для газовой смеси, подчиняющейся закону Дальтона, справедливы следующие положения: 1) каждый газ, входящий в газовую смесь, имеет температуру, равную температуру смеси; 2) каждый из компонентов газовой смеси распространяется по всему объему, занимаемому смесью, а поэтому объем каждого из них равен объему всей смеси; 3) каждый из газов, входящих в смесь, подчиняется своему уравнению состояния; 4) смесь в целом условно является как бы новым газом, отличающимся от ее компонентов и подчиняющимися своему уравнению состояния. Например, уравнение Менделеева имеет вид: для какого-нибудь одного компонента газовой смеси и для всей смеси Разделив первое уравнение на второе, получим: откуда следует
Следовательно, парциальное давление компонента газовой смеси равно произведению его молярной доли на давление смеси. Заключение При выполнении данной работы, мы познакомились с такой наукой как Техническая термодинамика и теплотехника, узнали, когда она зародилась и что привело её к дальнейшему развитию. Познакомились с процессами, протекающими в термодинамике и величинами определяющие характеристики веществ, сопровождаемые данными процессами. Приобрели навык применения некоторых законов термодинамики при решении практических задач.
Список рекомендуемой литературы
1. Богданов С.Н., Клецкий А.В., Куприянова А.В. Сборник задач по технической термодинамике. – СПб. 2. Данилова Г.Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. - М.: Колос. 3. Ерофеев В.Л., Прохин А.С. Теплофизические основы судовой энергетики. - СПб: Государственный университет водных коммуникаций (СПГУВК). 4. Коновалова Л.С. Техническая термодинамика: Задачи для самостоятельной работы студентов. — Томск: ТПУ. 5. Корабельщиков Н.И. Сборник задач по технической термодинамике. – М.: Речфлот. 6. Кузовлев В.А. Техническая термодинамика и основы теплопередачи. – М.: Высшая школа. 7. Методические указания. Решение задач по газовым законам и термодинамике. — Магнитогорск: Гос. Институт. 8. Миклас А.Г. Судовые ДВС. – Л.: Судостроение. 9. Овсянников М.К., Костылев Н.И. Теплотехника. Техническая термодинамика и теплопередача. - СПб: ЭЛМОР. 10. Петренко А.Д. Судовые энергетические установки, вспомогательные и рыбопромысловые механизмы. – Л.: Судостроение. 11. Правила технической эксплуатации судовых вспомогательных паровых котлов. – С-пб.: Гипрорыбфлот. 12. Прибытков И.А., Левицкий И.А. Теоретические основы теплотехники. - М.: АКАДЕМА, 2004. 13. Рабинович О.М. Задачник по технической теплотехнике. – М.:Машиностроение. 14. Селин В.В. Теплотехника: Учебник для ВУЗов. - Калининград: Ка-лининград. кн. издат., 2001. 15. Теоретические основы хладотехники / Под ред. д.т.н. проф. Гуйко Э.И. - М.: Колос. - ч. 1,2.
|
||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 662. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |















 .
. ,
, .
. ,
,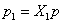 .
.