
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Что образуется в результате атмосферной коррозии никеля, покрытого магнием? Составьте уравнения электродных процессов.Стр 1 из 2Следующая ⇒ КОНТРОЛЬНАЯ РАБОТА
по дисциплине: «Химия»
вариант 14
г. Княгинино 2018
Содержание Модуль 1. 3 14. Объяснить валентные возможности элемента 34Se. 3 44. Как изменяются окислительные и восстановительные свойства элементов VIIA-подгруппы периодической системы с увеличением заряда ядра атомов? Почему? Какая из двух реакций возможна: 1) I2 + 5Cl2 +6H2O = 2HIO3 + 10HCl 2) 5I2 + Cl2 + 6H2O = 10 Hl + 2HClO3 3 74. Напишите реакцию горения этана С2Н6, если в результате образуются СО2 и Н2О. Вычислите тепловой эффект этой реакции, энтальпию и энтропию в стандартных условиях. 4 104. Реакция идет по уравнению Н2+I2=2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2]=0,04 моль/л, [I2]=0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2]=0,03 моль/л. 5 134. Константа равновесия гомогенной системы СО(г) + Н2О(г) = СО2(г)+Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации [СО]исх = 0,10 моль/л, [Н2О]исх =0,40 моль/л 6 Модуль 2. 7 14. При какой активности ионов Рb2+ равновесный потенциал свинцового электрода при 298 К будет равен стандартному потенциалу никелевого электрода? 7 44. При электролизе растворов каких солей: NaCl, K2S, CuSO4, KI — у анода выделяется кислород? Составьте уравнения электронных процессов. 8 74. Что образуется в результате атмосферной коррозии никеля, покрытого магнием? Составьте уравнения электродных процессов. 9  104. Назовите полимеры, полученные на основе этилена. Составьте схемы их полимеризации. 9 134. Установлено, что медные кристаллы высокой чистоты (менее 10-5 % примесей) имеют сопротивление в 10 раз меньше, чем ранее полученные кристаллы (примеси ~10-4%). Объясните это уменьшение. 10 164. Реакции выражаются схемами: KMnO4+Na2SO3+KOH→K2MnO4+Na2SO4+H2ONaCrO2+Br2+NaOH→Na2CrO4+NaBr+H2O 11 Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем: какое вещество окисляется, какое восстанавливается. К какой группе относятся окислительно-восстановительные реакции? 11 Список литературы_ 12
Модуль 1.
14.Объяснить валентные возможности элемента 34Se. Решение: Селен – 34й по счету элемент периодической системы химических элементов Менделеева, находится в VIа группе. В ядре атома селенасодержится 34 протона и 45 нейтронов (массовое число равно 79). В атоме селена есть 4 энергетических уровня, на которых находятся 34 электрона. Электронная формула атома селена имеет вид: а энергетическая диаграмма для электронов внешнего энергетического уровня, которые называются валентными:
Наличие двух неспаренных электронов свидетельствует о том, что селен способен проявлять валентность 2.
44. Как изменяются окислительные и восстановительные свойства элементов VIIA-подгруппы периодической системы с увеличением заряда ядра атомов? Почему? Какая из двух реакций возможна: 1) I2 + 5Cl2 +6H2O = 2HIO3 + 10HCl 2) 5I2 + Cl2 + 6H2O = 10 Hl + 2HClO3
Решение: С увеличением заряда ядра атомов (с возрастанием порядкового номера элементов) усиливаются восстановительные свойства и ослабевают окислительные, т.к. с увеличением радиуса атома электроны всё слабее притягиваются к ядру атома. Из двух реакций возможна
Монохлорид йода (
74. Напишите реакцию горения этана С2Н6, если в результате образуются СО2 и Н2О. Вычислите тепловой эффект этой реакции, энтальпию и энтропию в стандартных условиях. Решение:
По закону Гесса: Энтальпия реакции равна разности суммы энтальпий образования конечных и начальных участников реакции с учетом их стехиометрических коэффициентов
Тепловой эффект реакции:
Термохимическое уравнение:
Термодинамическое уравнение:
Энтропии реакции:
104. Реакция идет по уравнению Н2+I2=2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2]=0,04 моль/л, [I2]=0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2]=0,03 моль/л.
Решение:
Чему равна скорость химической реакции Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
2) В тот момент, когда концентрация значит в этот момент
Тогда
134. Константа равновесия гомогенной системы СО(г) + Н2О(г) = СО2(г)+Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации [СО]исх = 0,10 моль/л, [Н2О]исх =0,40 моль/л
Обозначим равновесные концентрации следующим образом:
Тогда уравнение реакции запишем
Константа равновесия
Т.к. из уравнения реакции
Т.к. исходные концентрации реагирующих веществ по условию задачи равны 0,1
Тогда:
Следовательно константы равновесия Равновесная концентрация Равновесная концентрация Модуль 2.
14. При какой активности ионов Рb2+ равновесный потенциал свинцового электрода при 298 К будет равен стандартному потенциалу никелевого электрода?
44. При электролизе растворов каких солей: NaCl, K2S, CuSO4, KI — у анода выделяется кислород? Составьте уравнения электронных процессов.
1)
2)
3)
На аноде выделится кислород. 3)
Что образуется в результате атмосферной коррозии никеля, покрытого магнием? Составьте уравнения электродных процессов.
Вторичная реакция:
Ржавчина – смесь
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 392. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |




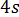

 ) реагирует с водой с образованием йодноватистой кислоты
) реагирует с водой с образованием йодноватистой кислоты 




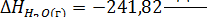




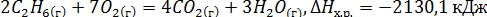












 станет 0,03
станет 0,03  его расход составит
его расход составит 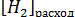 =
= 
 так же израсходовалось
так же израсходовалось  и его концентрация станет равной:
и его концентрация станет равной:
 0,16
0,16 







 равна
равна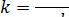
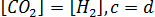 , поэтому
, поэтому
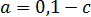








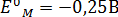 – стандартный потенциал электрода.
– стандартный потенциал электрода.
 –стандартный потенциал
–стандартный потенциал 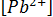



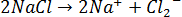


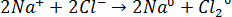

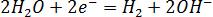




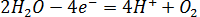











 и
и 