Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
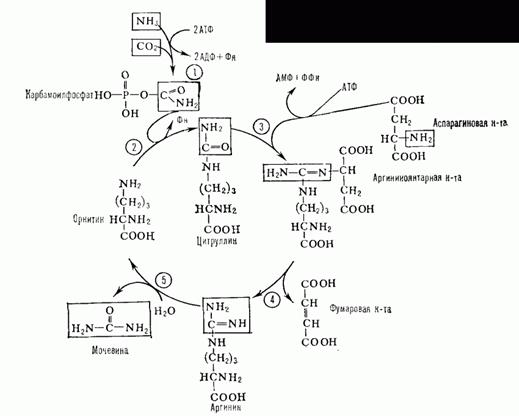
Активация панкреатических ферментовВ поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбок-сипептидазы А и В. Активация трипсиногена происходит под действием фермента энтеропептидазы. Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В. Специфичность действия протеаз Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.  Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, обладающий широкой специфичностью по отношению к N-концевым аминокислотам. Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды. В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот. В. Защита клеток от действия протеаз Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что: эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс. В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Синтез мочевины. Орнитиновый цикл. Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником
Суммарное уравнение синтеза мочевины:СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04 + АМФ + H4P2O7.
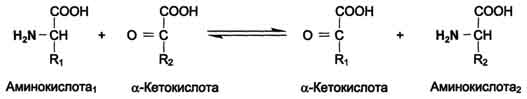
Желтухи Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах, закупорка желчевыводящих протоков печени. содержание билирубина в крови повышается. При достижении определённой концентрации он диффундирует в ткани, окрашивая их в жёлтый цвет. Пожелтение тканей называют желтухой. Клинически желтуха может не проявляться до тех пор, пока концентрация билирубина в плазме крови не станет выше 50 мкмоль/л. 1. Гемолитическая (надпечёночная) желтухарезультат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Основная причина - наследственные или приобретённые гемолитические анемии. Гипербилирубинемия у больных гемолитической желтухой обусловлена значительным повышением (103 - 171 мкмоль/л) в крови концентрации непрямой билирубин). Образование в печени и поступление в кишечник больших количеств прямого билирубина ведёт к усиленному образованию и выделению с калом и мочой уробилиногенов. Один из главных признаков гемолитической желтухи - повышение содержания в крови непрямого билирубина. Неконъюгированный билирубин токсичен. нарушает в митохондрии дыхание и окислительное фосфорилирование. Желтуха новорождённых "физиологическая желтуха", наблюдающаяся в первые дни жизни ребёнка. Причина - ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина. 2. Печёночно-клеточная желтухаобусловлена повреждением гепатоцитов и жёлчных капилляров при острых вирусных инфекциях, хроническом и токсических гепатитах. Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые не могут переводить конъюгированный билирубин из клеток в жёлчь против градиента концентрации. В результате деструкции печёночной паренхимы образующийся прямой билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе. Экскреция жёлчи также нарушена. 3. Механическая желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной При полной закупорке общего жёлчного протока конъюгированный билирубин в составе желчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать. Кал обесцвечен. происходит утечка билирубина в кровь, в крови повышена концентрация конъюгированного билирубина. Растворимый билирубин экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет. Билет №16 1-Трансаминирование - реакция переноса α-аминогруппы с ак-ы на α-кетокислоту, в результате чего образуются новая кетокислота и новая ак. процесс трансаминирования легко обратим Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
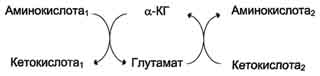
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартати соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат.Основным донором аминогруппы служит глутамат.
Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются: АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы. ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом. образуются оксалоацетат и глутамат. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени. органоспецифичность этих ферментов. В норме в крови активность этих ферментов составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и скелетных мышц, их используют для диагностики болезней этих органов. В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса".В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 2,0 раза. При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз, a ACT - в 2-4 раза.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 233. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
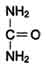 одногоиз них является аммиак,который в печени связывается с диоксидом углерода с образованием.
одногоиз них является аммиак,который в печени связывается с диоксидом углерода с образованием.