Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Пространственная организация белковых молекулВыполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию.
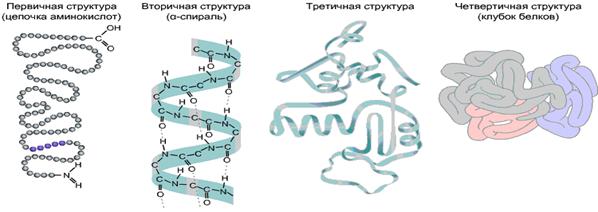
Рис. 5 уровня пространственной организации белков.
Выделяют 4 уровня пространственной организации белков. Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная. Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия. Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).  Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо. Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток. Тесты: 1.В ядре клетке из про-иРНК образована молекула зрелой иРНК, имеющая меньший размер, чем незрелая иРНК. Совокупность этапов этого превращения называется: А. Процессинг; Б. Репликация; В. Рекогниция; Г. Трансляция Д. Терминация. 2. Одним из этапов синтеза белка является рекогниция. Первой триплет иРНК начинается триплета - УАУ. Какой комплементарный триплет находится в тРНК А. УАУ Б. ГУГ. В. УГУ. Г. ЦУЦ. Д. АУА. 3. В здоровой клетке слюнной железы человека исследуются процессы биосинтеза ферментов. Основным направлением потока информации в этой клетке будет: А. иРНК > полипептид > ДНК. Б. ДНК > иРНК > полипептид. В. тРНК > иРНК > ДНК > полипептид. Г.ДНК > полипептид > иРНК. Д. Полипептид > иРНК > ДНК. 4. К рибосоме подошла зрелая иРНК, в молекуле которой находятся структурные кодоны. Эти кодоны в процессе биосинтеза полипептида являются сигналом: А. Присоединения РНК-синтетазы. Б. Соединения определенных экзонов. В. Началу транскрипции. Г. Окончания транскрипции. Д.Присоединения определенной аминокислоты. 5. В гене зашифрована информация о: А. строении белков, жиров, углеводов Б. первичной структуре белка В. последовательности нуклеотидов в ДНК Г. последовательности нуклеотидов в и-РНК Д. структуре нуклеотидов ДНК и РНК. 6. Какой из нуклеотидов не входит в состав ДНК? А. тимин Б. урацил В. гуанин Г. цитозин Д. аденин. 7. Трансляция при биосинтезе белка осуществляется: А. в ядре Б. на рибосоме В. в митохондриях Г. на лизосомах Д. на гладкой ЭПС. 8. В соматических клетках многоклеточного организма: А. различный набор генов и белков Б. одинаковый набор генов и белков Г. одинаковый набор генов, но разный набор белков Д. одинаковый набор белков, но разный набор генов 9. Материальный носитель наследственной информации в эукариотической клетке А. и-РНК Б. р-РНК В. ДНК Г. белок Д. про-и-РНК 10. Транскрипция при биосинтезе белка осуществляется: А. в ядре Б. на рибосоме В. на ЭПС Г. в митохондриях Д. в вакуолях.
Задачи для контроля знаний: Задача 1. Определите, что тяжелее - белок или кодирующий его ген. Задача 2. Определите длину и массу структурного гена, кодирующего белок, который имеет молекулярную массу 3200 дальтон. Задача 3. Определите длину и массу гена, если известно, что в составе 20% интронов, а масса кодируемого им полипептида 1600 дальтон. Задача 4. Последовательность нуклеотидов в кодирующей цепочке ДНК: ААА ГГА ТТЦ ЦАА ЦЦТ АТЦ ГТЦ. Постройте соответствующую последовательность аминокислот в полипептиде, если известно,что 7-11 и 15-17 нуклеотиды интроны. Задача 5. Вес полипептида 3000 дальтон, вес одного участка цепочки ДНК, где закодирована последовательность нуклеотидов этого полипептида 93000. Какова доля интронов в этом участке ДНК? Задача 6. Постройте фрагмент гена, кодирующего полипептид: лей-вал-сер-асп-сер-цист-глу-non.
6.Материалы для разбора с преподавателем и контроля его усвоения: 6.1. Разбор с преподавателем узловых вопросов для освоения темы занятия. 6.2. Демонстрация преподавателем методик практических приемов по теме. 6.3. Материал для контроля усвоения материала: Вопросы для разбора с преподавателем: 1. Молекулярные основы наследственности. Организации наследственного аппарата у прокариот и эукариот. Цитоплазматическая наследственность. 2. Строение гена. Гены структурны, регуляторные, синтеза тРНК и рРНК. 3. Структурно-функциональная классификация генов. 4. Основные этапы биосинтеза белка в клетке. 5. Транскрипция. Процессинг, сплайсинг. 6. Трансляция (инициация, элонгация, терминация). Постранслянционная модификация белков (пространственные изменения). 7. Ферменты, принимающие участие в процессе биосинтеза белка. Практическая часть 1. Рассмотреть рис. 1 и рис. 2. Разобрать с их помощью особенности разных этапов биосинтеза белка. 2. Решить задачи.
8.Литература: Основная: 1. Биология: В 2кн. Кн.1: Учеб. для мед.спец. вузов /под ред. В.Н.Ярыгина. 6-е изд. -М.:Высшая школа,2004.- С.166-170 2. Биология/А.А.Слюсарев, С.В.Жукова.- К.: Вища школа. Головное изд-во, 1992 - С.33, 84-88 3. Биология. Руководство к практическим занятиям для студентов стоматологических факультетов под ред. акад. РАЕН проф. В.В. Маркиной. Изд. М. « ГЭОТАР- Медиа» 2010 г.
Дополнительная: 1.Медична біологія: Підручник /за ред.В.П.Пішака , Ю.І.Бажори.-Вінниця:Нова книга,2004.- С.26-28, 104-107 2.Албертс Г., Грей Д., Льюис Дж. и др. Молекулярная биология клетки. М.: Мир,1986. – В 3 т, 2-е изд. Т.1.- С. 176-177 3.Граф логической структуры. 4.Конспект лекций.
Занятие №6 Тема:«Регуляция биосинтеза белка. Геном человека. Геномные технологии. Геномика.» 1.Актуальность темы:изучение данной темы необходимо для понимания теоретических основ генетики. Знания о геноме человека позволяет решать многие проблемы биологии и медицины с совершенно новых позиций. Своевременная диагностика, профилактика и эффективное лечение многих болезней (генетически обусловленнных патологий, в т.ч. болезней обмена веществ и рака), будет возможно с помощью применения геномных технологий и методов генетической инженерии. Генетическая инженерия использует введение в геном генов и хромосом с определенными свойствами. Все это будет возможно, если знать не только структуру и функции генов, но и регуляцию биосинтеза белка на разных этапах реализации наследственной информации, и применять эти достижения, основываясь на теоретических и практических данных. 2.Учебные цели занятия:изучить регуляцию биосинтеза белка на разных этапах реализации наследственной информации в клетке. Ознакомиться с результатами программы «Геном человека», понятиями «геномика», «геномные технологии». Уметь решать типовые задачи по теме. 3.Цели развития личности:профессиональные 4. Оснащение:а) методический материал, таблицы; б) световые микроскопы, в) постоянные микропрепараты, дидактический материал и технические средства обучения (кино- и видеофильмы, тренинговые и контролирующие компьютерные программы, мультимедийные атласы, альбомы, ситуационные задачи и др.).
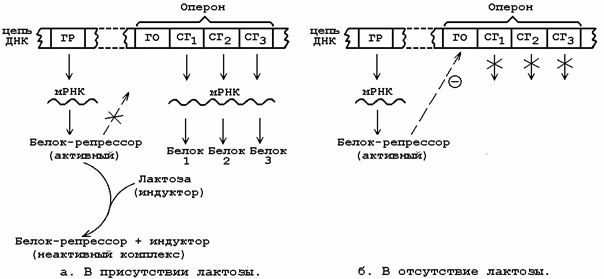
1. Материалы для самоподготовки: 5.1. Вспомогательный учебный материал Регуляция биосинтеза белка Прокариоты. Теория регуляции биосинтеза у прокариот была разработана в 1961 г. Ф. Жакобом и Ж. Моно. Основные положения теории: 1. неоднородность генетического материала. В геноме имеются: - структурные гены, которые кодируют синтез структурных белков или ферментов; - регуляторные гены. Обеспечивают регуляцию считывания информации со структурных генов. 2. регуляция биосинтеза происходит на этапе транскрипции; 3. регуляция осуществляется путем репрессии (подавление транскрипции) и индукции (разрешение транскрипции). Пример: работа лактозного оперона.
ОПЕРОН, транскриптон, скриптон, участок генетич. материала, транскрипция к-рого осуществляется на одну молекулу информационной РНК (иРНК) под контролем белка-репрессора. Концепция О. разработана в 1961 Ф. Жакобом и Ж. Моно для объяснения механизма «включения» или «выключения» тех или иных генов в зависимости от потребности клетки в метаболитах, синтез к-рых контролируют эти гены. В дальнейшем эта концепция получила подтверждение в большом числе экспериментов, показавших, что оперонная регуляция (т. е. регуляция на уровне транскрипции) представляет собой осн. механизм регуляции активности генов у прокариот и бактериофагов. О. может состоять из одного, двух и более тесно сцепленных структурных генов, кодирующих белки (ферменты), осуществляющие последовательные этапы биосинтеза какого-либо метаболита.
В состав оперона входит несколько структурных генов (СГ), кодирующих синтез функционально связанных друг с другом белков (например, ферментов одного метаболического пути), а также ген-оператор (ГО), управляющий транскрипцией структурных генов. К гену-оператору примыкает промотор - начальный участок инициации транскрипции. Функция гена-оператора контролируется пространственно удалённым геном-регулятором (ГР), продуцирующим белок-репрессор, который может находиться в активной либо неактивной форме. Активный белок-репрессор способен взаимодействовать с геном-оператором и блокировать область промотора. Это препятствует присоединению РНК-полимеразы к промотору и транскрипция структурных генов отменяется.Вещества, вызывающие инактивацию белка-репрессора, являются индукторами синтеза белка. Отсутствие активного белка-репрессора приводит к разблокированию промотора и транскрипция становится возможной. Синтезируемая мРНК поступает на рибосому и становится матрицей для синтеза ферментного белка. Эукариоты. Основные уровни регуляции биосинтеза: 1. на уровне транскрипции. Варианты: - групповая репрессия генов белками – гистонами; - амплификация генов - увеличение числа копий заданного участка ДНК или гена. Достигается в результате многократного синтеза ДНК в одном и том же репликативном пузыре. В этом случае транскрипция будет возможна сразу с нескольких копий гена, что увеличивается скорость транскрипции. Эта регуляция изучается у опухолевых клеток, которые способны к амлификации; - регуляция сигналами-усилителями. Сигналы-усилители - энхансеры - выступающий участок ДНК, который может быть значительно удален от промотора. Под действием энхансера наблюдается более чем 200-кратное увеличение скорости транскрипции. Действует неспецифично, усиливая транскрипцию многих генов. Пример: действие гормонов коры надпочечников: глюкокортикоиды проникают внутрь клетки, где взаимодействуют с рецептором, посредством чего проникают в ядро, где присоединяются к ДНК и превращают участок ДНК в энхансер. При этом запускается синтез ферментов, характерных для действия глюкокортикоидов. Данный механизм работает только у эукариот. 2. регуляция на уровне процессинга иРНК: - разрешение или запрещение процессинга. Так, не все пре-иРНК превращаются в зрелые иРНК; - дифференциальный (альтернативный) процессинг. В клетках эукариот возможен многовариантный процессинг, поэтому утверждение 1 ген=1 белок для них не всегда справедливо. Альтернативный процессинг возможен в результате потери некоторых экзонов. Пример: С-клетки щитовидной железы и нейроны имеют одинаковый ген, который в С-клетках кодирует выработку кальцитонина (регулирует уровень Са2+), а в нейронах дифференцирует процессинг белка CGRP-пептид (регулирует АД). 3. на уровне стабильности и активности иРНК. Чем больше иРНК находится в стабильном состоянии в цитоплазме, тем большее количество молекул белка на ней может быть синтезировано. Поэтому в цитоплазме иРНК консервируются путем взаимодействия с белками-информатионами, образуя комплексы - информосомы. 4. регуляция на уровне трансляции: - тотальная репрессия или активация трансляции при изменении активности и количества белковых факторов; - избирательная дискриминация иРНК, например, при инфицировании клетки вирусом транслируется вирусная РНК, а РНК хозяина дискриминируется. - механизм повышения эффективности трансляции включает образование полисом - это комплекс нескольких рибосом с одной иРНК.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 330. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |